1 2 –∑–∞–∫–æ–Ω —Ñ–∞—Ä–∞–¥–µ—è





§ 76. Законы Фарадея для электролиза
–ö–æ–≥–¥–∞ –∏–æ–Ω—ã —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞ –¥–æ—Ö–æ–¥—è—Ç –¥–æ —ç–ª–µ–∫—Ç—Ä–æ–¥–æ–≤, —Å–æ–µ–¥–∏–Ω–µ–Ω–Ω—ã—Ö —Å –ø–æ–ª—é—Å–∞–º–∏ –∏—Å—Ç–æ—á–Ω–∏–∫–∞ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–≥–æ —Ç–æ–∫–∞, —Ç–æ –ø–æ–ª–æ–∂–∏—Ç–µ–ª—å–Ω—ã–µ –∏–æ–Ω—ã –ø–æ–ª—É—á–∞—é—Ç –Ω–µ–¥–æ—Å—Ç–∞—é—â–∏–µ —ç–ª–µ–∫—Ç—Ä–æ–Ω—ã –æ—Ç –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª—å–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞ –∏ –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ —Ä–µ–∞–∫—Ü–∏–∏ –≤–æ—Å—Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–∏—è –ø—Ä–µ–≤—Ä–∞—â–∞—é—Ç—Å—è –≤ –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–µ –∞—Ç–æ–º—ã (–º–æ–ª–µ–∫—É–ª—ã); –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª—å–Ω—ã–µ –∏–æ–Ω—ã –æ—Ç–¥–∞—é—Ç —ç–ª–µ–∫—Ç—Ä–æ–Ω—ã –ø–æ–ª–æ–∂–∏—Ç–µ–ª—å–Ω–æ–º—É —ç–ª–µ–∫—Ç—Ä–æ–¥—É –∏ –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ —Ä–µ–∞–∫—Ü–∏–∏ –æ–∫–∏—Å–ª–µ–Ω–∏—è –ø—Ä–µ–≤—Ä–∞—â–∞—é—Ç—Å—è –≤ –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–µ –∞—Ç–æ–º—ã. –Ø–≤–ª–µ–Ω–∏–µ –≤—ã–¥–µ–ª–µ–Ω–∏—è –≤–µ—â–µ—Å—Ç–≤–∞ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ –æ–∫–∏—Å–ª–∏—Ç–µ–ª—å–Ω–æ-–≤–æ—Å—Å—Ç–∞–Ω–æ–≤–∏—Ç–µ–ª—å–Ω–æ–π —Ä–µ–∞–∫—Ü–∏–∏ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ —Ç–æ–∫–∞ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–æ–º. –í–ø–µ—Ä–≤—ã–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑ –Ω–∞–±–ª—é–¥–∞–ª –≤ 1803 –≥. –≤ –ü–µ—Ç–µ—Ä–±—É—Ä–≥–µ — –í. –ü. –ü–µ—Ç—Ä–æ–≤. –í 1833-1834 –≥–≥. –∞–Ω–≥–ª–∏–π—Å–∫–∏–π —Ñ–∏–∑–∏–∫ –ú. –§–∞—Ä–∞–¥–µ–π –æ—Ç–∫—Ä—ã–ª –∑–∞–∫–æ–Ω—ã —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞, –∫–æ—Ç–æ—Ä—ã–µ —É—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞—é—Ç, –æ—Ç —á–µ–≥–æ –∏ –∫–∞–∫ –∑–∞–≤–∏—Å–∏—Ç –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤–∞.
–ü—Ä–æ–ø—É—Å–∫–∞—è –≤ —Ç–µ—á–µ–Ω–∏–µ –æ–¥–∏–Ω–∞–∫–æ–≤—ã—Ö –ø—Ä–æ–º–µ–∂—É—Ç–∫–æ–≤ –≤—Ä–µ–º–µ–Ω–∏ —Ç–æ–∫ –æ–¥–Ω–æ–π –∏ —Ç–æ–π –∂–µ —Å–∏–ª—ã —á–µ—Ä–µ–∑ —Ä–∞–∑–Ω—ã–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç—ã, –§–∞—Ä–∞–¥–µ–π —É—Å—Ç–∞–Ω–æ–≤–∏–ª, —á—Ç–æ –ø—Ä–∏ —ç—Ç–æ–º –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤—ã–¥–µ–ª—è—é—Ç—Å—è —Ä–∞–∑–ª–∏—á–Ω—ã–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ –≤–µ—â–µ—Å—Ç–≤–∞. –¢–∞–∫, —Ç–æ–∫ –≤ 1 –∞ –∑–∞ 1 —Å–µ–∫ –∏–∑ —Ä–∞—Å—Ç–≤–æ—Ä–∞ –∞–∑–æ—Ç–Ω–æ–∫–∏—Å–ª–æ–≥–æ —Å–µ—Ä–µ–±—Ä–∞ –≤—ã–¥–µ–ª—è–µ—Ç 1,118 –º–≥ —Å–µ—Ä–µ–±—Ä–∞, –∏–∑ —Ä–∞—Å—Ç–≤–æ—Ä–∞ –º–µ–¥–Ω–æ–≥–æ –∫—É–ø–æ—Ä–æ—Å–∞ — 0,328 –º–≥ –º–µ–¥–∏. –ó–Ω–∞—á–∏—Ç, –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª—è–µ–º–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –∑–∞–≤–∏—Å–∏—Ç –æ—Ç –≤–µ—â–µ—Å—Ç–≤–∞. –°–∫–∞–ª—è—Ä–Ω–∞—è –≤–µ–ª–∏—á–∏–Ω–∞, –∏–∑–º–µ—Ä—è–µ–º–∞—è –º–∞—Å—Å–æ–π –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ —Ç–æ–∫–æ–º –≤1 –∞–∑–∞1 —Å–µ–∫, –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–º (–æ–±–æ–∑–Ω–∞—á–∞–µ—Ç—Å—è k). –≠–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –∏–º–µ–µ—Ç –Ω–∞–∏–º–µ–Ω–æ–≤–∞–Ω–∏–µ –∫–≥ /–∞*—Å–µ–∫, –∏–ª–∏ –∫–≥ /–∫.
–ï—Å–ª–∏ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å –≤ —Ç–µ—á–µ–Ω–∏–µ –≤—Ä–µ–º–µ–Ω–∏ t —á–µ—Ä–µ–∑ —Ä–∞—Å—Ç–≤–æ—Ä –º–µ–¥–Ω–æ–≥–æ –∫—É–ø–æ—Ä–æ—Å–∞ –Ω–µ–±–æ–ª—å—à–æ–π —Ç–æ–∫, —Ç–æ –∫–∞—Ç–æ–¥ —Å–ª–∞–±–æ –ø–æ–∫—Ä—ã–≤–∞–µ—Ç—Å—è –º–µ–¥—å—é, –∞ –µ—Å–ª–∏ —Ç–æ–∫ –±–æ–ª—å—à–µ–π —Å–∏–ª—ã — —Ç–æ –∑–∞ —Ç–æ –∂–µ –≤—Ä–µ–º—è –Ω–∞ –∫–∞—Ç–æ–¥–µ –≤—ã–¥–µ–ª–∏—Ç—Å—è –±–æ–ª—å—à–µ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –º–µ–¥–∏. –û—Å—Ç–∞–≤–∏–º —Å–∏–ª—É —Ç–æ–∫–∞ —Ç–æ–π –∂–µ, –Ω–æ —É–≤–µ–ª–∏—á–∏–º —Ç–µ–ø–µ—Ä—å –≤—Ä–µ–º—è. –ó–∞–º–µ—á–∞–µ–º, —á—Ç–æ –º–µ–¥–∏ –≤—ã–¥–µ–ª—è–µ—Ç—Å—è –µ—â–µ –±–æ–ª—å—à–µ. –ü—Ä–æ–ø—É—Å–∫–∞—è —á–µ—Ä–µ–∑ —Ä–∞–∑–Ω—ã–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç—ã —Ä–∞–∑–ª–∏—á–Ω—ã–µ —Ç–æ–∫–∏ –∏ —Ç—â–∞—Ç–µ–ª—å–Ω–æ –∏–∑–º–µ—Ä—è—è –º–∞—Å—Å—É –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª—è—é—â–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –∏–∑ –∫–∞–∂–¥–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞, –§–∞—Ä–∞–¥–µ–π –æ—Ç–∫—Ä—ã–ª –ø–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞: –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö, –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –ø—Ä–æ–∏–∑–≤–µ–¥–µ–Ω–∏—é —Å–∏–ª—ã —Ç–æ–∫–∞ –∏ –≤—Ä–µ–º–µ–Ω–∏ –µ–≥–æ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç.
–¢–æ–∫ –≤ 1 –∞ –∑–∞ 1 —Å–µ–∫ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤—ã–¥–µ–ª—è–µ—Ç –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –∫ –∫–≥ –≤–µ—â–µ—Å—Ç–≤–∞, –∞ —Ç–æ–∫ —Å–∏–ª–æ–π I –∞ –∑–∞ –≤—Ä–µ–º—è t —Å–µ–∫ — –≤ It —Ä–∞–∑ –±–æ–ª—å—à–µ:
–≠—Ç–æ —Ñ–æ—Ä–º—É–ª—ã –ø–µ—Ä–≤–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è –¥–ª—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞.
–ö–∞–∂–¥—ã–π –∏–æ–Ω –Ω–µ—Å–µ—Ç —Å —Å–æ–±–æ–π –∏ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—É—é –º–∞—Å—Å—É –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –≤–µ–ª–∏—á–∏–Ω—É –∑–∞—Ä—è–¥–∞, –ø–æ—ç—Ç–æ–º—É —á–µ–º –±–æ–ª—å—à–µ –∏–æ–Ω–æ–≤ –ø–æ–¥—Ö–æ–¥–∏—Ç –∫ —ç–ª–µ–∫—Ç—Ä–æ–¥—É, —Ç. –µ. —á–µ–º —Å–∏–ª—å–Ω–µ–µ —Ç–æ–∫ –≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–µ, —Ç–µ–º –±–æ–ª—å—à–µ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –≤—ã–¥–µ–ª—è–µ—Ç—Å—è –≤–µ—â–µ—Å—Ç–≤–∞.
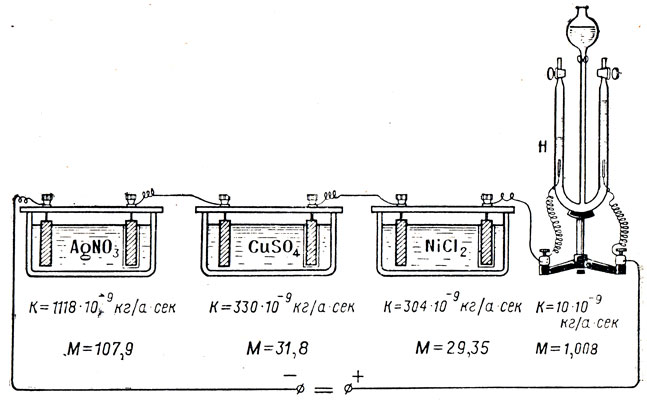
–§–∞—Ä–∞–¥–µ–π, –ø—Ä–æ–ø—É—Å–∫–∞—è –æ–¥–∏–Ω –∏ —Ç–æ—Ç –∂–µ —Ç–æ–∫ –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ —á–µ—Ä–µ–∑ –Ω–µ—Å–∫–æ–ª—å–∫–æ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–æ–≤, –∑–∞–º–µ—Ç–∏–ª, —á—Ç–æ –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤–µ—â–µ—Å—Ç–≤–∞ –Ω–µ–æ–¥–∏–Ω–∞–∫–æ–≤–∞, —Ö–æ—Ç—è —Å–∏–ª–∞ —Ç–æ–∫–∞ –∏ –≤—Ä–µ–º—è –µ–≥–æ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è —á–µ—Ä–µ–∑ —Ä–∞–∑–ª–∏—á–Ω—ã–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç—ã –±—ã–ª–∏ –æ–¥–Ω–∏–º–∏ –∏ —Ç–µ–º–∏ –∂–µ (—Ä–∏—Å. 109). –¢–æ—á–Ω–æ –≤–∑–≤–µ—Å–∏–≤ –≤—ã–¥–µ–ª–∏–≤—à–∏–µ—Å—è –≤–µ—â–µ—Å—Ç–≤–∞, –§–∞—Ä–∞–¥–µ–π –∑–∞–º–µ—Ç–∏–ª, —á—Ç–æ –≤–µ—Å –∏—Ö –Ω–µ —Å–ª—É—á–∞–µ–Ω, –∞ –∑–∞–≤–∏—Å–∏—Ç –æ—Ç —Ö–∏–º–∏—á–µ—Å–∫–æ–π –ø—Ä–∏—Ä–æ–¥—ã –≤–µ—â–µ—Å—Ç–≤–∞. –ù–∞ –∫–∞–∂–¥—ã–π –≥—Ä–∞–º–º –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –≤–æ–¥–æ—Ä–æ–¥–∞ –≤—Å–µ–≥–¥–∞ –ø–æ–ª—É—á–∞–ª–æ—Å—å 107,9 –≥ —Å–µ—Ä–µ–±—Ä–∞; 31,8 –≥ –º–µ–¥–∏; 29,35 –≥ –Ω–∏–∫–µ–ª—è. –ü–æ—Å–ª–µ –≤–≤–µ–¥–µ–Ω–∏—è —Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ — –æ—Ç–Ω–æ—à–µ–Ω–∏—è –∞—Ç–æ–º–Ω–æ–π –º–∞—Å—Å—ã (–≤–µ—Å–∞) –∫ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ 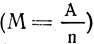 — –æ–∫–∞–∑–∞–ª–æ—Å—å, —á—Ç–æ —ç—Ç–∏ —á–∏—Å–ª–∞ —è–≤–ª—è—é—Ç—Å—è —Ö–∏–º–∏—á–µ—Å–∫–∏–º–∏ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞–º–∏ –¥–∞–Ω–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤. –¢–∞–∫ –∫–∞–∫ –∞—Ç–æ–º–Ω–∞—è –º–∞—Å—Å–∞ –ê –∏ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å n — —á–∏—Å–ª–∞ –æ—Ç–≤–ª–µ—á–µ–Ω–Ω—ã–µ, —Ç–æ –∏ –æ—Ç–Ω–æ—à–µ–Ω–∏–µ
— –æ–∫–∞–∑–∞–ª–æ—Å—å, —á—Ç–æ —ç—Ç–∏ —á–∏—Å–ª–∞ —è–≤–ª—è—é—Ç—Å—è —Ö–∏–º–∏—á–µ—Å–∫–∏–º–∏ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞–º–∏ –¥–∞–Ω–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤. –¢–∞–∫ –∫–∞–∫ –∞—Ç–æ–º–Ω–∞—è –º–∞—Å—Å–∞ –ê –∏ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å n — —á–∏—Å–ª–∞ –æ—Ç–≤–ª–µ—á–µ–Ω–Ω—ã–µ, —Ç–æ –∏ –æ—Ç–Ω–æ—à–µ–Ω–∏–µ 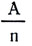 —á–∏—Å–ª–æ –æ—Ç–≤–ª–µ—á–µ–Ω–Ω–æ–µ.
—á–∏—Å–ª–æ –æ—Ç–≤–ª–µ—á–µ–Ω–Ω–æ–µ.
–Ý–∏—Å. 109. –ö–æ –≤—Ç–æ—Ä–æ–º—É –∑–∞–∫–æ–Ω—É –§–∞—Ä–∞–¥–µ—è –¥–ª—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞
–Ý–∞–∑–¥–µ–ª–∏–≤ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã –≤–µ—â–µ—Å—Ç–≤ –Ω–∞ –∏—Ö —Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã, ( k /M), –ø–æ–ª—É—á–∏–º:
–¥–ª—è Ag 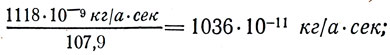
–¥–ª—è Cu 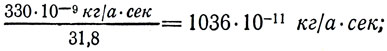
–¥–ª—è Ni 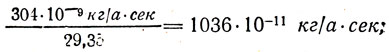
–¥–ª—è –ù 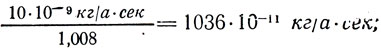
—Ç. –µ. –æ–¥–Ω–æ –∏ —Ç–æ –∂–µ —á–∏—Å–ª–æ 1036*10 -11 –∫–≥ /–∞*—Å–µ–∫ –∏–ª–∏ 1036*10 -11 –∫–≥ /–∫. –û–±–æ–∑–Ω–∞—á–∏–≤ —ç—Ç–æ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–µ —á–∏—Å–ª–æ –±—É–∫–≤–æ–π –°, –∑–∞–ø–∏—à–µ–º: C = 1036*10 -11 –∫–≥ /–∞*—Å–µ–∫. –°–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ, 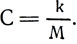 –û—Ç—Å—é–¥–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç
–û—Ç—Å—é–¥–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç
–≠—Ç–æ —Ñ–æ—Ä–º—É–ª–∞ –≤—Ç–æ—Ä–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è –¥–ª—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞, –∫–æ—Ç–æ—Ä—ã–π —á–∏—Ç–∞–µ—Ç—Å—è —Ç–∞–∫: —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã –≤–µ—â–µ—Å—Ç–≤ –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –∏—Ö —Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞–º.
–ó–∞–º–µ–Ω–∏–≤ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –≤ —Ñ–æ—Ä–º—É–ª–µ –ø–µ—Ä–≤–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è, –ø–æ–ª—É—á–∏–º —Ñ–æ—Ä–º—É–ª—É –æ–±–æ–±—â–µ–Ω–Ω–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è –¥–ª—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞:
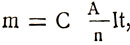
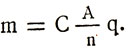
–ú–∞—Å—Å—ã –≤—ã–¥–µ–ª–∏–≤—à–∏—Ö—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤ –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –∏—Ö –∞—Ç–æ–º–Ω—ã–º –≤–µ—Å–∞–º –∏ –∑–∞—Ä—è–¥—É, –ø—Ä–æ—à–µ–¥—à–µ–º—É —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç, –∏ –æ–±—Ä–∞—Ç–Ω–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ –≤–µ—â–µ—Å—Ç–≤–∞.
–ó–∞–∫–æ–Ω—ã –§–∞—Ä–∞–¥–µ—è —è–≤–ª—è—é—Ç—Å—è —Å–ª–µ–¥—Å—Ç–≤–∏–µ–º –∏–æ–Ω–Ω–æ–π –ø—Ä–æ–≤–æ–¥–∏–º–æ—Å—Ç–∏ —Ç–æ–∫–∞ –≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–µ. –ü–æ—è—Å–Ω–∏–º —ç—Ç–æ –Ω–∞ —Ç–∞–∫–∏—Ö –ø—Ä–∏–º–µ—Ä–∞—Ö. –î–æ–ø—É—Å—Ç–∏–º, —á—Ç–æ –ø—Ä–æ–∏–∑–≤–æ–¥–∏–ª—Å—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑ –æ–¥–Ω–æ–≤–∞–ª–µ–Ω—Ç–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤, –Ω–∞–ø—Ä–∏–º–µ—Ä —Ä–∞—Å—Ç–≤–æ—Ä–æ–≤ NaCl –∏ AgNO3. –í–µ–ª–∏—á–∏–Ω—ã –∑–∞—Ä—è–¥–æ–≤ –∏–æ–Ω–æ–≤ Na –∏ Ag –æ–¥–∏–Ω–∞–∫–æ–≤—ã. –ö–æ–≥–¥–∞ –∏–æ–Ω—ã –ø–µ—Ä–µ–Ω–æ—Å—è—Ç —Ä–∞–≤–Ω—ã–µ –ø–æ –≤–µ–ª–∏—á–∏–Ω–µ –∑–∞—Ä—è–¥—ã, –∫–∞–∫ –≤ —Ç–æ–º, —Ç–∞–∫ –∏ –≤ –¥—Ä—É–≥–æ–º —Ä–∞—Å—Ç–≤–æ—Ä–µ –∫ —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤—É—é—â–∏–º —ç–ª–µ–∫—Ç—Ä–æ–¥–∞–º –ø–æ–¥–æ–π–¥–µ—Ç –æ–¥–∏–Ω–∞–∫–æ–≤–æ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –∏–æ–Ω–æ–≤. –ù–æ –ø—Ä–∏ —Ä–∞–≤–Ω–æ–º —á–∏—Å–ª–µ –ø–æ–¥–æ—à–µ–¥—à–∏—Ö –∏–æ–Ω–æ–≤ –º–∞—Å—Å—ã –æ—Ç–ª–æ–∂–∏–≤—à–∏—Ö—Å—è –≤–µ—â–µ—Å—Ç–≤ Na –∏ Ag –±—É–¥—É—Ç –Ω–µ –æ–¥–∏–Ω–∞–∫–æ–≤—ã, —Ç–∞–∫ –∫–∞–∫ —Ä–∞–∑–ª–∏—á–Ω—ã –º–∞—Å—Å—ã —Å–∞–º–∏—Ö –∞—Ç–æ–º–æ–≤ Na –∏ Ag. –£ –Ω–∞—Ç—Ä–∏—è –∞—Ç–æ–º–Ω–∞—è –º–∞—Å—Å–∞ 22,997; —É —Å–µ—Ä–µ–±—Ä–∞ — 107,88; –ø–æ—ç—Ç–æ–º—É —Å–µ—Ä–µ–±—Ä–∞ –≤—ã–¥–µ–ª–∏—Ç—Å—è –ø–æ—á—Ç–∏ –≤ –ø—è—Ç—å —Ä–∞–∑ –±–æ–ª—å—à–µ. –ó–Ω–∞—á–∏—Ç, –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ, –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–æ –µ–≥–æ –∞—Ç–æ–º–Ω–æ–π –º–∞—Å—Å–µ, —á—Ç–æ –∏ —É—Ç–≤–µ—Ä–∂–¥–∞–µ—Ç—Å—è –∑–∞–∫–æ–Ω–æ–º –§–∞—Ä–∞–¥–µ—è.
–í —Å–ª—É—á–∞–µ, –∫–æ–≥–¥–∞ –≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ —É—á–∞—Å—Ç–≤—É—é—Ç –∏–æ–Ω—ã —Ä–∞–∑–Ω–æ–π –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏, –Ω–∞–ø—Ä–∏–º–µ—Ä –êl, –∏–º–µ—é—â–∏–π –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å, —Ä–∞–≤–Ω—É—é 3, –∏ Na —Å –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å—é, —Ä–∞–≤–Ω–æ–π 1, –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –∏–æ–Ω–æ–≤ –êl –∏ Na, –ø–µ—Ä–µ–Ω–æ—Å—è—â–∏—Ö –æ–¥–∏–Ω –∏ —Ç–æ—Ç –∂–µ –∑–∞—Ä—è–¥, –±—É–¥–µ—Ç —Ä–∞–∑–ª–∏—á–Ω–æ. –ß–µ–º –±–æ–ª—å—à–µ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å –∏–æ–Ω–∞, —Ç. –µ. —á–µ–º –±–æ–ª—å—à–µ –µ–≥–æ –∑–∞—Ä—è–¥, —Ç–µ–º –º–µ–Ω—å—à–µ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –∏–æ–Ω–æ–≤ –ø–æ—Ç—Ä–µ–±—É–µ—Ç—Å—è –¥–ª—è –ø–µ—Ä–µ–Ω–æ—Å–∞ –¥–∞–Ω–Ω–æ–≥–æ –∑–∞—Ä—è–¥–∞ (–Ω–∞–ø—Ä–∏–º–µ—Ä, –∏–æ–Ω–æ–≤ –êl –Ω–∞–¥–æ –≤ —Ç—Ä–∏ —Ä–∞–∑–∞ –º–µ–Ω—å—à–µ, —á–µ–º –∏–æ–Ω–æ–≤ Na). –¢–∞–∫–æ–π –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç—å—é –º–µ–∂–¥—É –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å—é –∏ –∑–∞—Ä—è–¥–æ–º –∏–æ–Ω–∞ –∏ –æ–±—ä—è—Å–Ω—è–µ—Ç—Å—è —Ç–æ, —á—Ç–æ –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤–∞ –æ–±—Ä–∞—Ç–Ω–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –µ–≥–æ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏.
–ë–ª–∞–≥–æ–¥–∞—Ä—è –ø—Ä–æ—Å—Ç–æ—Ç–µ, –¥–µ—à–µ–≤–∏–∑–Ω–µ –∏ –±–æ–ª—å—à–æ–π —á–∏—Å—Ç–æ—Ç–µ –ø–æ–ª—É—á–µ–Ω–Ω—ã—Ö –ø—Ä–æ–¥—É–∫—Ç–æ–≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑ –ø–æ–ª—É—á–∏–ª —à–∏—Ä–æ–∫–æ–µ –ø—Ä–∏–º–µ–Ω–µ–Ω–∏–µ –≤ –ø—Ä–æ–º—ã—à–ª–µ–Ω–Ω–æ—Å—Ç–∏ –¥–ª—è –¥–æ–±—ã–≤–∞–Ω–∏—è –∞–ª—é–º–∏–Ω–∏—è –∏–∑ –±–æ–∫—Å–∏—Ç–æ–≤—ã—Ö —Ä—É–¥, –æ—á–∏—Å—Ç–∫–∏ –º–µ—Ç–∞–ª–ª–æ–≤ (–Ω–∞–ø—Ä–∏–º–µ—Ä, –º–µ–¥–∏, —Ü–∏–Ω–∫–∞, –∑–æ–ª–æ—Ç–∞, —Å–µ—Ä–µ–±—Ä–∞) –æ—Ç –ø—Ä–∏–º–µ—Å–µ–π, –ø–æ–∫—Ä—ã—Ç–∏—è –º–µ—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö –ø—Ä–µ–¥–º–µ—Ç–æ–≤ —Å–ª–æ–µ–º –¥—Ä—É–≥–æ–≥–æ –º–µ—Ç–∞–ª–ª–∞ —Å —Ü–µ–ª—å—é –ø—Ä–µ–¥–æ—Ö—Ä–∞–Ω–µ–Ω–∏—è –∏—Ö –æ—Ç —Ä–∂–∞–≤—á–∏–Ω—ã, –ø—Ä–∏–¥–∞–Ω–∏—è —Ç–≤–µ—Ä–¥–æ—Å—Ç–∏ –∏—Ö –ø–æ–≤–µ—Ä—Ö–Ω–æ—Å—Ç–∏ (–Ω–∏–∫–µ–ª–∏—Ä–æ–≤–∞–Ω–∏–µ, —Ö—Ä–æ–º–∏—Ä–æ–≤–∞–Ω–∏–µ), –¥–ª—è –∏–∑–≥–æ—Ç–æ–≤–ª–µ–Ω–∏—è —É–∫—Ä–∞—à–µ–Ω–∏–π (—Å–µ—Ä–µ–±—Ä–µ–Ω–∏–µ, –∑–æ–ª–æ—á–µ–Ω–∏–µ), –ø–æ–ª—É—á–µ–Ω–∏—è –º–µ—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö –∫–æ–ø–∏–π —Å —Ä–µ–ª—å–µ—Ñ–Ω—ã—Ö –ø—Ä–µ–¥–º–µ—Ç–æ–≤ (–Ω–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ –∏–∑–≥–æ—Ç–æ–≤–ª–µ–Ω–∏–∏ –ø–∞—Ç–µ—Ñ–æ–Ω–Ω—ã—Ö –ø–ª–∞—Å—Ç–∏–Ω–æ–∫, –º–∞—Ç—Ä–∏—Ü, –∫–ª–∏—à–µ).
–ó–∞–¥–∞—á–∞ 30. –°–≤–∏–Ω–µ—Ü –≤—ã—Å–æ–∫–æ–π —á–∏—Å—Ç–æ—Ç—ã, –ø—Ä–∏–º–µ–Ω—è–µ–º—ã–π –≤ –∞—Ç–æ–º–Ω–æ–π —ç–Ω–µ—Ä–≥–µ—Ç–∏–∫–µ, –ø–æ–ª—É—á–∞—é—Ç —ç–ª–µ–∫—Ç—Ä–æ—Ä–∞—Ñ–∏–Ω–∏—Ä–æ–≤–∞–Ω–∏–µ–º. –í—ã—á–∏—Å–ª–∏—Ç—å –º–∞—Å—Å—É —Å–≤–∏–Ω—Ü–∞, –≤—ã–¥–µ–ª–µ–Ω–Ω—É—é –∑–∞ 1 —á —Ç–æ–∫–æ–º –ø–ª–æ—Ç–Ω–æ—Å—Ç—å—é 0,02 –∞ /—Å–º 2 –∏ –Ω–∞–ø—Ä—è–∂–µ–Ω–∏–µ–º 0,5 –≤. –í—ã—Ö–æ–¥ –ø–æ —Ç–æ–∫—É 95%. –ö–∞–∫–æ–≤ —Ä–∞—Å—Ö–æ–¥ —ç–ª–µ–∫—Ç—Ä–æ—ç–Ω–µ—Ä–≥–∏–∏ –Ω–∞ –≤—ã–¥–µ–ª–µ–Ω–∏–µ 1 –∫–≥ —Å–≤–∏–Ω—Ü–∞? –ü–ª–æ—â–∞–¥—å –æ–±—â–µ–≥–æ —Å–µ—á–µ–Ω–∏—è –∫–∞—Ç–æ–¥–æ–≤, –Ω–∞ –∫–æ—Ç–æ—Ä—ã—Ö –æ—Ç–ª–∞–≥–∞–µ—Ç—Å—è —Å–≤–∏–Ω–µ—Ü, 10 –º 2 .

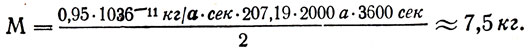
–ü—Ä–∏ –∫ –ø. –¥. —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∏—á–µ—Å–∫–æ–π –≤–∞–Ω–Ω—ã 100% –∑–∞ —Å—á–µ—Ç –≤—Å–µ–π –∏–∑—Ä–∞—Å—Ö–æ–¥–æ–≤–∞–Ω–Ω–æ–π —ç–ª–µ–∫—Ç—Ä–æ—ç–Ω–µ—Ä–≥–∏–∏ A = UIt –≤—ã–¥–µ–ª–∏–ª–æ—Å—å –±—ã —Å–≤–∏–Ω—Ü–∞ m = klt, –ø–æ—ç—Ç–æ–º—É –Ω–∞ –≤—ã–¥–µ–ª–µ–Ω–∏–µ 1 –∫–≥ —Å–≤–∏–Ω—Ü–∞ –∏–∑—Ä–∞—Å—Ö–æ–¥–æ–≤–∞–Ω–æ —ç–Ω–µ—Ä–≥–∏–∏ 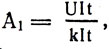 –∏–ª–∏
–∏–ª–∏ 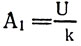
–ü–µ—Ä–≤—ã–π –∏ –≤—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è
–≠–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –≤—Å–µ–≥–¥–∞ –∏–º–µ–µ—Ç –æ–ø—Ä–µ–¥–µ–ª—ë–Ω–Ω–æ–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –∏–æ–Ω–æ–≤ —Å–æ –∑–Ω–∞–∫–∞–º–∏ «–ø–ª—é—Å» –∏ «–º–∏–Ω—É—Å», –ø–æ–ª—É—á–∏–≤—à–∏—Ö—Å—è –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –≤–∑–∞–∏–º–æ–¥–µ–π—Å—Ç–≤–∏—è –º–æ–ª–µ–∫—É–ª —Ä–∞—Å—Ç–≤–æ—Ä—ë–Ω–Ω–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞ —Å —Ä–∞—Å—Ç–≤–æ—Ä–∏—Ç–µ–ª–µ–º. –ö–æ–≥–¥–∞ –≤ –Ω–µ–º –≤–æ–∑–Ω–∏–∫–∞–µ—Ç —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–µ –ø–æ–ª–µ, –∏–æ–Ω—ã –Ω–∞—á–∏–Ω–∞—é—Ç –¥–≤–∏–≥–∞—Ç—å—Å—è –∫ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞–º, –ø–æ–ª–æ–∂–∏—Ç–µ–ª—å–Ω—ã–µ —É—Å—Ç—Ä–µ–º–ª—è—é—Ç—Å—è –∫ –∫–∞—Ç–æ–¥—É, –æ—Ç—Ä–∏—Ü–∞—Ç–µ–ª—å–Ω—ã–µ ‚Äì –∫ –∞–Ω–æ–¥—É. –î–æ–π–¥—è –¥–æ —ç–ª–µ–∫—Ç—Ä–æ–¥–æ–≤, –∏–æ–Ω—ã –æ—Ç–¥–∞—é—Ç –∏–º —Å–≤–æ–∏ –∑–∞—Ä—è–¥—ã, –ø—Ä–µ–≤—Ä–∞—â–∞—é—Ç—Å—è –≤ –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–µ –∞—Ç–æ–º—ã –∏ –æ—Ç–ª–∞–≥–∞—é—Ç—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö. –ß–µ–º –±–æ–ª—å—à–µ –∏–æ–Ω–æ–≤ –ø–æ–¥–æ–π–¥—ë—Ç –∫ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞–º, —Ç–µ–º –±–æ–ª—å—à–µ –±—É–¥–µ—Ç –æ—Ç–ª–æ–∂–µ–Ω–æ –Ω–∞ –Ω–∏—Ö –≤–µ—â–µ—Å—Ç–≤–∞.
–ö —ç—Ç–æ–º—É –∑–∞–∫–ª—é—á–µ–Ω–∏—é –º—ã –º–æ–∂–µ–º –ø—Ä–∏–π—Ç–∏ –∏ –æ–ø—ã—Ç–Ω—ã–º –ø—É—Ç—ë–º. –ü—Ä–æ–ø—É—Å—Ç–∏–º —Ç–æ–∫ —á–µ—Ä–µ–∑ –≤–æ–¥–Ω—ã–π —Ä–∞—Å—Ç–≤–æ—Ä –º–µ–¥–Ω–æ–≥–æ –∫—É–ø–æ—Ä–æ—Å–∞ –∏ –±—É–¥–µ–º –Ω–∞–±–ª—é–¥–∞—Ç—å –∑–∞ –≤—ã–¥–µ–ª–µ–Ω–∏–µ–º –º–µ–¥–∏ –Ω–∞ —É–≥–æ–ª—å–Ω–æ–º –∫–∞—Ç–æ–¥–µ. –ú—ã –æ–±–Ω–∞—Ä—É–∂–∏–º, —á—Ç–æ –≤–Ω–∞—á–∞–ª–µ –æ–Ω –ø–æ–∫—Ä–æ–µ—Ç—Å—è –µ–¥–≤–∞ –∑–∞–º–µ—Ç–Ω—ã–º —Å–ª–æ–µ–º –º–µ–¥–∏, –∑–∞—Ç–µ–º –ø–æ –º–µ—Ä–µ –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏—è —Ç–æ–∫–∞ –æ–Ω –±—É–¥–µ—Ç —É–≤–µ–ª–∏—á–∏–≤–∞—Ç—å—Å—è, –∞ –ø—Ä–∏ –¥–æ–ª–≥–æ–≤—Ä–µ–º–µ–Ω–Ω–æ–º –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏–∏ —Ç–æ–∫–∞ –º–æ–∂–Ω–æ –ø–æ–ª—É—á–∏—Ç—å –Ω–∞ —É–≥–æ–ª—å–Ω–æ–º —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –∑–Ω–∞—á–∏—Ç–µ–ª—å–Ω–æ–π —Ç–æ–ª—â–∏–Ω—ã —Å–ª–æ–π –º–µ–¥–∏, –∫ –∫–æ—Ç–æ—Ä–æ–º—É –ª–µ–≥–∫–æ –ø—Ä–∏–ø–∞—è—Ç—å, –Ω–∞–ø—Ä–∏–º–µ—Ä, –º–µ–¥–Ω—ã–π –ø—Ä–æ–≤–æ–¥.
–Ø–≤–ª–µ–Ω–∏–µ –≤—ã–¥–µ–ª–µ–Ω–∏—è –≤–µ—â–µ—Å—Ç–≤–∞ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤–æ –≤—Ä–µ–º—è –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è —Ç–æ–∫–∞ —Å–∫–≤–æ–∑—å —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–æ–º.
Пропуская через разные электролизы различные токи и тщательно измеряя массу вещества, выделяющегося на электродах из каждого электролита, английский физик Фарадей в 1833 – 1834 гг. открыл два закона для электролиза.
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è —É—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞–µ—Ç –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç—å –º–µ–∂–¥—É –º–∞—Å—Å–æ–π –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –≤–µ—â–µ—Å—Ç–≤–∞ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –∏ –≤–µ–ª–∏—á–∏–Ω–æ–π –∑–∞—Ä—è–¥–∞, –∫–æ—Ç–æ—Ä—ã–π –ø—Ä–æ—à–µ–ª —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç.
–ó–∞–∫–æ–Ω —ç—Ç–æ—Ç —Ñ–æ—Ä–º—É–ª–∏—Ä—É–µ—Ç—Å—è —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º: –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –∫–æ—Ç–æ—Ä–∞—è –≤—ã–¥–µ–ª–∏–ª–∞—Å—å –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ, –Ω–∞ –∫–∞–∂–¥–æ–º —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –≤–µ–ª–∏—á–∏–Ω–µ –∑–∞—Ä—è–¥–∞, –∫–æ—Ç–æ—Ä—ã–π –ø—Ä–æ—à–µ–ª —Å–∫–≤–æ–∑—å —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç:
где m – масса вещества, которое выделилось, q – заряд.
Величина k – электрохимическимй эквивалент вещества. Она характерна для каждого вещества, выделяющегося при электролите.
–ï—Å–ª–∏ –≤ —Ñ–æ—Ä–º—É–ª–µ –ø—Ä–∏–Ω—è—Ç—å q = 1 –∫—É–ª–æ–Ω—É, —Ç–æ–≥–¥–∞ k = m, —Ç.–µ. —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –≤–µ—â–µ—Å—Ç–≤–∞ –±—É–¥–µ—Ç —á–∏—Å–ª–µ–Ω–Ω–æ —Ä–∞–≤–Ω—è—Ç—å—Å—è –º–∞—Å—Å–µ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –∏–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ –∑–∞—Ä—è–¥–∞ –≤ –æ–¥–∏–Ω –∫—É–ª–æ–Ω.
–í—ã—Ä–∞–∂–∞—è –≤ —Ñ–æ—Ä–º—É–ª–µ –∑–∞—Ä—è–¥ —á–µ—Ä–µ–∑ —Ç–æ–∫ I –∏ –≤—Ä–µ–º—è t, –ø–æ–ª—É—á–∏–º:
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –ø—Ä–æ–≤–µ—Ä—è–µ—Ç—Å—è –Ω–∞ –æ–ø—ã—Ç–µ —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º. –ü—Ä–æ–ø—É—Å—Ç–∏–º —Ç–æ–∫ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç—ã –ê, –í –∏ –°. –ï—Å–ª–∏ –≤—Å–µ –æ–Ω–∏ –æ–¥–∏–Ω–∞–∫–æ–≤—ã–µ, —Ç–æ –º–∞—Å—Å—ã –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞ –≤ –ê, –í –∏ –° –±—É–¥—É—Ç –æ—Ç–Ω–æ—Å–∏—Ç—å—Å—è –∫–∞–∫ —Ç–æ–∫–∏ I, I1, I2. –ü—Ä–∏ —ç—Ç–æ–º –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –≤ –ê, –±—É–¥–µ—Ç —Ä–∞–≤–Ω–æ —Å—É–º–º–µ –æ–±—ä–µ–º–æ–≤, –≤—ã–¥–µ–ª–µ–Ω–Ω—ã—Ö –≤ –í –∏ –°, —Ç–∞–∫ –∫–∞–∫ —Ç–æ–∫ I= I1+ I2.
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è —É—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞–µ—Ç –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç—å —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ –æ—Ç –∞—Ç–æ–º–Ω–æ–≥–æ –≤–µ—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –µ–≥–æ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ –∏ —Ñ–æ—Ä–º—É–ª–∏—Ä—É–µ—Ç—Å—è —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º: —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –≤–µ—â–µ—Å—Ç–≤–∞ –±—É–¥–µ—Ç –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª–µ–Ω –∏—Ö –∞—Ç–æ–º–Ω–æ–º—É –≤–µ—Å—É, –∞ —Ç–∞–∫–∂–µ –æ–±—Ä–∞—Ç–Ω–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª–µ–Ω –µ–≥–æ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏.
–û—Ç–Ω–æ—à–µ–Ω–∏–µ –∞—Ç–æ–º–Ω–æ–≥–æ –≤–µ—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞ –∫ –µ–≥–æ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–º –≤–µ—â–µ—Å—Ç–≤–∞. –í–≤–µ–¥—è —ç—Ç—É –≤–µ–ª–∏—á–∏–Ω—É, –≤—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è —Å—Ñ–æ—Ä–º—É–ª–∏—Ä–æ–≤–∞—Ç—å –º–æ–∂–Ω–æ –∏–Ω–∞—á–µ: —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã –≤–µ—â–µ—Å—Ç–≤–∞ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –∏—Ö —Å–æ–±—Å—Ç–≤–µ–Ω–Ω—ã–º —Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞–º.
Пусть электрохимические эквиваленты разных веществ соответственно равны k1 и k2, k3, …, kn, химические же эквиваленты тех же веществ x1 и x2, x23, …, xn, тогда k1 /k2 = x1 /x2, или k1/x1 = k2/x2 = k3/ x3 = … = kn/ xn.
–ò–Ω–∞—á–µ –≥–æ–≤–æ—Ä—è, –æ—Ç–Ω–æ—à–µ–Ω–∏–µ –≤–µ–ª–∏—á–∏–Ω—ã —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ –≤–µ—â–µ—Å—Ç–≤–∞ –∫ –≤–µ–ª–∏—á–∏–Ω–µ —Ç–æ–≥–æ –∂–µ –≤–µ—â–µ—Å—Ç–≤–∞ –µ—Å—Ç—å –≤–µ–ª–∏—á–∏–Ω–∞ –ø–æ—Å—Ç–æ—è–Ω–Ω–∞—è, –∏–º–µ—é—â–∞—è –¥–ª—è –≤—Å–µ—Ö –≤–µ—â–µ—Å—Ç–≤ –æ–¥–Ω–æ –∏ —Ç–æ –∂–µ –∑–Ω–∞—á–µ–Ω–∏–µ:
–û—Ç—Å—é–¥–∞ —Å–ª–µ–¥—É–µ—Ç, —á—Ç–æ –æ—Ç–Ω–æ—à–µ–Ω–∏–µ k/x —è–≤–ª—è–µ—Ç—Å—è –ø–æ—Å—Ç–æ—è–Ω–Ω—ã–º –¥–ª—è –≤—Å–µ—Ö –≤–µ—â–µ—Å—Ç–≤:
k/x=c = 0, 01036 (–º–≥-—ç–∫–≤)/–∫.
–í–µ–ª–∏—á–∏–Ω–∞ —Å –ø–æ–∫–∞–∑—ã–≤–∞–µ—Ç, —Å–∫–æ–ª—å–∫–æ –º–∏–ª–ª–∏–≥—Ä–∞–º–º-—ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–≤ –≤–µ—â–µ—Å—Ç–≤–∞ –≤—ã–¥–µ–ª—è–µ—Ç—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤–æ –≤—Ä–µ–º—è –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ –∑–∞—Ä—è–¥–∞, —Ä–∞–≤–Ω–æ 1 –∫—É–ª–æ–Ω—É. –í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –ø—Ä–µ–¥—Å—Ç–∞–≤–ª–µ–Ω —Ñ–æ—Ä–º—É–ª–æ–π:
–ü–æ–¥—Å—Ç–∞–≤–ª—è—è –ø–æ–ª—É—á–µ–Ω–Ω–æ–µ –≤—ã—Ä–∞–∂–µ–Ω–∏–µ –¥–ª—è k –≤ –ø–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è, –æ–±–∞ –º–æ–∂–Ω–æ –æ–±—ä–µ–¥–∏–Ω–∏—Ç—å –≤ –æ–¥–Ω–æ–º –≤—ã—Ä–∞–∂–µ–Ω–∏–∏:
где с – универсальная постоянная, равная 0, 00001036 (г-экв)/к.
–≠—Ç–∞ —Ñ–æ—Ä–º—É–ª–∞ –ø–æ–∫–∞–∑—ã–≤–∞–µ—Ç, —á—Ç–æ, –ø—Ä–æ–ø—É—Å–∫–∞—è –æ–¥–∏–Ω–∞–∫–æ–≤—ã–µ —Ç–æ–∫–∏ –≤ —Ç–µ—á–µ–Ω–∏–µ –æ–¥–Ω–æ–≥–æ –∏ —Ç–æ–≥–æ –∂–µ –ø—Ä–æ–º–µ–∂—É—Ç–∫–∞ –≤—Ä–µ–º–µ–Ω–∏ —á–µ—Ä–µ–∑ –¥–≤–∞ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞, –º—ã –≤—ã–¥–µ–ª–∏–º –∏–∑ –æ–±–æ–∏—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–æ–≤ –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ –≤–µ—â–µ—Å—Ç–≤, –æ—Ç–Ω–æ—Å—è—â–∏—Ö—Å—è –∫–∞–∫ —Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã —Ç–∞–∫–æ–≤—ã—Ö.
–¢–∞–∫ –∫–∞–∫ x=A/n, —Ç–æ –º–æ–∂–Ω–æ –Ω–∞–ø–∏—Å–∞—Ç—å:
—Ç.–µ., –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ, –±—É–¥–µ—Ç –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –µ–≥–æ –∞—Ç–æ–º–Ω–æ–º—É –≤–µ—Å—É, —Ç–æ–∫—É, –≤—Ä–µ–º–µ–Ω–∏ –∏ –æ–±—Ä–∞—Ç–Ω–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏.
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –¥–ª—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞, —Ç–∞–∫ –∂–µ, –∫–∞–∫ –∏ –ø–µ—Ä–≤—ã–π, –Ω–µ–ø–æ—Å—Ä–µ–¥—Å—Ç–≤–µ–Ω–Ω–æ –≤—ã—Ç–µ–∫–∞–µ—Ç –∏–∑ –∏–æ–Ω–Ω–æ–≥–æ —Ö–∞—Ä–∞–∫—Ç–µ—Ä–∞ —Ç–æ–∫–∞ –≤ —Ä–∞—Å—Ç–≤–æ—Ä–µ.
–ó–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è, –õ–µ–Ω—Ü–∞, –∞ —Ç–∞–∫–∂–µ –º–Ω–æ–≥–∏—Ö –¥—Ä—É–≥–∏—Ö –≤—ã–¥–∞—é—â–∏—Ö—Å—è —Ñ–∏–∑–∏–∫–æ–≤ —Å—ã–≥—Ä–∞–ª –æ–≥—Ä–æ–º–Ω—É—é —Ä–æ–ª—å –≤ –∏—Å—Ç–æ—Ä–∏–∏ —Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–∏—è –∏ —Ä–∞–∑–≤–∏—Ç–∏—è —Ñ–∏–∑–∏–∫–∏.
–ó–∞–∫–æ–Ω—ã —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è
Как уже известно, при электролизе на электродах происходит выделение вещества. Попробуем выяснить, от чего будет зависеть масса это вещества. Масса выделившегося вещества m будет равна произведению массы одного иона m0i на число ионов Ni, которые достигли электрода за промежуток времени равный ∆t: m = m0i*Ni. Масса иона m0i будет вычисляться по следующей формуле:
–≥–¥–µ –ú — –º–æ–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –∞ Na — –ø–æ—Å—Ç–æ—è–Ω–Ω–∞—è –ê–≤–æ–≥–∞–¥—Ä–æ.
–ß–∏—Å–ª–æ –∏–æ–Ω–æ–≤, –∫–æ—Ç–æ—Ä—ã–µ –¥–æ—Å—Ç–∏–≥–Ω—É—Ç —ç–ª–µ–∫—Ç—Ä–æ–¥–∞, –≤—ã—á–∏—Å–ª—è–µ—Ç—Å—è –ø–æ —Å–ª–µ–¥—É—é—â–µ–π —Ñ–æ—Ä–º—É–ª–µ:
–≥–¥–µ ‚àÜq = I*‚àÜt — –∑–∞—Ä—è–¥, –ø—Ä–æ—à–µ–¥—à–∏–π —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –∑–∞ –≤—Ä–µ–º—è, —Ä–∞–≤–Ω–æ–µ ‚àÜt, q0i — –∑–∞—Ä—è–¥ –∏–æ–Ω–∞.
–î–ª—è —Ç–æ–≥–æ, —á—Ç–æ–±—ã –æ–ø—Ä–µ–¥–µ–ª–∏—Ç—å –∑–∞—Ä—è–¥ –∏–æ–Ω–∞, –∏—Å–ø–æ–ª—å–∑—É–µ—Ç—Å—è —Å–ª–µ–¥—É—é—â–∞—è —Ñ–æ—Ä–º—É–ª–∞:
–≥–¥–µ n — –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å, e — —ç–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω—ã–π –∑–∞—Ä—è–¥.
–°–æ–±–∏—Ä–∞—è –≤–æ–µ–¥–∏–Ω–æ –≤—Å–µ –ø—Ä–µ–¥—Å—Ç–∞–≤–ª–µ–Ω–Ω—ã–µ —Ñ–æ—Ä–º—É–ª—ã, –ø–æ–ª—É—á–∞–µ–º —Ñ–æ—Ä–º—É–ª—É –¥–ª—è –≤—ã—á–∏—Å–ª–µ–Ω–∏—è –º–∞—Å—Å—ã –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –≤–µ—â–µ—Å—Ç–≤–∞:
Теперь обозначим через k коэффициент пропорциональности между массой вещества и зарядом ∆q.
–≠—Ç–æ—Ç –∫–æ—ç—Ñ—Ñ–∏—Ü–∏–µ–Ω—Ç k –±—É–¥–µ—Ç –∑–∞–≤–∏—Å–µ—Ç—å –æ—Ç –ø—Ä–∏—Ä–æ–¥—ã –≤–µ—â–µ—Å—Ç–≤–∞. –¢–æ–≥–¥–∞ —Ñ–æ—Ä–º—É–ª—É –º–∞—Å—Å—ã –≤–µ—â–µ—Å—Ç–≤–∞ –º–æ–∂–Ω–æ –ø–µ—Ä–µ–ø–∏—Å–∞—Ç—å –≤ —Å–ª–µ–¥—É—é—â–µ–º –≤–∏–¥–µ:
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è
–ú–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –∑–∞ –≤—Ä–µ–º—è, —Ä–∞–≤–Ω–æ–µ ‚àÜt, –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ —Ç–æ–∫–∞ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ —Å–∏–ª–µ —Ç–æ–∫–∞ –∏ –≤—Ä–µ–º–µ–Ω–∏. –ö–æ—ç—Ñ—Ñ–∏—Ü–∏–µ–Ω—Ç k –Ω–∞–∑—ã–≤–∞—é—Ç —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–º –¥–∞–Ω–Ω–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞. –ï–¥–∏–Ω–∏—Ü–µ–π –∏–∑–º–µ—Ä–µ–Ω–∏—è —Å–ª—É–∂–∏—Ç –∫–≥/–ö–ª. –Ý–∞–∑–±–µ—Ä–µ–º—Å—è —Å —Ñ–∏–∑–∏—á–µ—Å–∫–∏–º —Å–º—ã—Å–ª–æ–º —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞. –¢–∞–∫ –∫–∞–∫:
—Ç–æ —Ñ–æ—Ä–º—É–ª—É —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ –º–æ–∂–Ω–æ –ø–µ—Ä–µ–ø–∏—Å–∞—Ç—å –≤ —Å–ª–µ–¥—É—é—â–µ–º –≤–∏–¥–µ:
–¢–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º, k — –æ—Ç–Ω–æ—à–µ–Ω–∏–µ –º–∞—Å—Å—ã –∏–æ–Ω–∞ –∫ –∑–∞—Ä—è–¥—É —ç—Ç–æ–≥–æ –∏–æ–Ω–∞.
–î–ª—è —Ç–æ–≥–æ, —á—Ç–æ–±—ã —É–¥–æ—Å—Ç–æ–≤–µ—Ä–∏—Ç—å—Å—è –≤ —Å–ø—Ä–∞–≤–µ–¥–ª–∏–≤–æ—Å—Ç–∏ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è, –º–æ–∂–Ω–æ –ø—Ä–æ–≤–µ—Å—Ç–∏ –æ–ø—ã—Ç. –õ–∞–±–æ—Ä–∞—Ç–æ—Ä–Ω–∞—è —É—Å—Ç–∞–Ω–æ–≤–∫–∞, –Ω–µ–æ–±—Ö–æ–¥–∏–º–∞—è –¥–ª—è –Ω–µ–≥–æ, –ø–æ–∫–∞–∑–∞–Ω–∞ –Ω–∞ —Å–ª–µ–¥—É—é—â–µ–º —Ä–∏—Å—É–Ω–∫–µ.

–í—Å–µ —Ç—Ä–∏ –µ–º–∫–æ—Å—Ç–∏ –∑–∞–ø–æ–ª–Ω–µ–Ω—ã –æ–¥–∏–Ω–∞–∫–æ–≤—ã–º —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∏—á–µ—Å–∫–∏–º —Ä–∞—Å—Ç–≤–æ—Ä–æ–º. –ß–µ—Ä–µ–∑ –Ω–∏—Ö –±—É–¥—É—Ç –ø—Ä–æ—Ç–µ–∫–∞—Ç—å —Ä–∞–∑–ª–∏—á–Ω—ã–µ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–µ —Ç–æ–∫–∏, –ø—Ä–∏—á–µ–º I1 = I2+I3. –ü–æ—Å–ª–µ –≤–∫–ª—é—á–µ–Ω–∏—è —É—Å—Ç–∞–Ω–æ–≤–∫–∏ –≤ —Ü–µ–ø—å –ø–æ–¥–æ–∂–¥–µ–º –Ω–µ–∫–æ—Ç–æ—Ä–æ–µ –≤—Ä–µ–º—è. –ü–æ—Ç–æ–º –æ—Ç–∫–ª—é—á–∏–º –µ—ë –∏ –∏–∑–º–µ—Ä–∏–º –º–∞—Å—Å—ã –≤–µ—â–µ—Å—Ç–≤, –≤—ã–¥–µ–ª–∏–≤—à–∏—Ö—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö –≤ –∫–∞–∂–¥–æ–º –∏–∑ —Å–æ—Å—É–¥–æ–≤ m1, m2, m3. –ú–æ–∂–Ω–æ –±—É–¥–µ—Ç —É–±–µ–¥–∏—Ç—å—Å—è, —á—Ç–æ –º–∞—Å—Å—ã –≤–µ—â–µ—Å—Ç–≤ –±—É–¥—É—Ç –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã —Å–∏–ª–∞–º —Ç–æ–∫–∞, –∫–æ—Ç–æ—Ä—ã–µ –ø—Ä–æ—Ö–æ–¥–∏–ª–∏ —á–µ—Ä–µ–∑ —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤—É—é—â–∏–π —Å–æ—Å—É–¥.
–º–æ–∂–Ω–æ –≤—ã—Ä–∞–∑–∏—Ç—å –∑–Ω–∞—á–µ–Ω–∏–µ –∑–∞—Ä—è–¥–∞ —ç–ª–µ–∫—Ç—Ä–æ–Ω–∞
–ï—Å–ª–∏ –ø–æ—Å—á–∏—Ç–∞—Ç—å –ø–æ —ç—Ç–æ–π —Ñ–æ—Ä–º—É–ª–µ, –º—ã –ø–æ–ª—É—á–∏–º –∑–Ω–∞—á–µ–Ω–∏–µ e = 1.6*10^(-19) –ö–ª.
–ò–º–µ–Ω–Ω–æ —Ç–∞–∫–∏–º —Å–ø–æ—Å–æ–±–æ–º –±—ã–ª–æ –≤–ø–µ—Ä–≤—ã–µ –ø–æ–ª—É—á–µ–Ω–æ –∑–Ω–∞—á–µ–Ω–∏–µ —ç–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ –∑–∞—Ä—è–¥–∞.
–Ø–≤–ª–µ–Ω–∏–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ –±—ã–ª–æ –∏–∑—É—á–µ–Ω–æ –ú. –§–∞—Ä–∞–¥–µ–µ–º. –ò–∑–º–µ—Ä—è—è –ø—Ä–æ—Ç–µ–∫—à–∏–π —á–µ—Ä–µ–∑ —Ä–∞—Å—Ç–≤–æ—Ä –∑–∞—Ä—è–¥ –∏ –º–∞—Å—Å—É –∫–∞—Ç–æ–¥–∞ –¥–æ –∏ –ø–æ—Å–ª–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞, –§–∞—Ä–∞–¥–µ–π —É—Å—Ç–∞–Ω–æ–≤–∏–ª, —á—Ç–æ –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª—è—é—â–µ–≥–æ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ, –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞, –ø—Ä–æ—Ç–µ–∫—à–µ–≥–æ —á–µ—Ä–µ–∑ —Ä–∞—Å—Ç–≤–æ—Ä:
–§–æ—Ä–º—É–ª–∞ (19.1) —è–≤–ª—è–µ—Ç—Å—è –º–∞—Ç–µ–º–∞—Ç–∏—á–µ—Å–∫–∏–º –≤—ã—Ä–∞–∂–µ–Ω–∏–µ–º –ø–µ—Ä–≤–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è.
–û–ø—ã—Ç—ã –§–∞—Ä–∞–¥–µ—è –ø–æ–∫–∞–∑–∞–ª–∏, —á—Ç–æ –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤–∞ –∑–∞–≤–∏—Å–∏—Ç –Ω–µ —Ç–æ–ª—å–∫–æ –æ—Ç –≤–µ–ª–∏—á–∏–Ω—ã –∑–∞—Ä—è–¥–∞ —Ü, –Ω–æ –∏ –æ—Ç —Ä–æ–¥–∞ –≤–µ—â–µ—Å—Ç–≤–∞. –ö–æ—ç—Ñ—Ñ–∏—Ü–∏–µ–Ω—Ç –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–æ—Å—Ç–∏ –∫, –≤—ã—Ä–∞–∂–∞—é—â–∏–π –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç—å –º–∞—Å—Å—ã –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤–∞ –æ—Ç –µ–≥–æ —Ä–æ–¥–∞, –Ω–∞–∑—ã–≤–∞—é—Ç —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–º –≤–µ—â–µ—Å—Ç–≤–∞. –≠–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –∏–∑–º–µ—Ä—è–µ—Ç—Å—è –º–∞—Å—Å–æ–π –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª—è—é—â–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –µ–¥–∏–Ω–∏—Ü—ã –∑–∞—Ä—è–¥–∞:
(–ü–æ–∫–∞–∂–∏—Ç–µ, —á—Ç–æ –≤ –°–ò –µ–¥–∏–Ω–∏—Ü–µ–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ k —è–≤–ª—è–µ—Ç—Å—è 1 –∫–≥/–ö–ª.)
–ü–æ—Å–∫–æ–ª—å–∫—É q =It, —Ç–æ –ø–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –º–æ–∂–Ω–æ –∑–∞–ø–∏—Å–∞—Ç—å —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º:
–ù–∞ –æ–ø—ã—Ç–µ –º–æ–∂–Ω–æ –æ–ø—Ä–µ–¥–µ–ª–∏—Ç—å —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã —Å –±–æ–ª—å—à–æ–π —Ç–æ—á–Ω–æ—Å—Ç—å—é. –í —Å–≤–æ–µ –≤—Ä–µ–º—è —ç—Ç–æ –ø–æ–∑–≤–æ–ª–∏–ª–æ –∏—Å–ø–æ–ª—å–∑–æ–≤–∞—Ç—å (19.1) –¥–ª—è –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –∫—É–ª–æ–Ω–∞ –ø–æ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–º—É —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—É —Å–µ—Ä–µ–±—Ä–∞, –∫–æ—Ç–æ—Ä—ã–π –±—ã–ª –∏–∑–º–µ—Ä–µ–Ω –æ—Å–æ–±–µ–Ω–Ω–æ —Ç—â–∞—Ç–µ–ª—å–Ω–æ –∏ –æ–∫–∞–∑–∞–ª—Å—è —Ä–∞–≤–Ω—ã–º 1,118*10 -6 –∫–≥/–ö–ª=1,118 –º–≥/–ö–ª.
Выясним, как теория объясняет результаты опытов Фарадея. Ион, разряжающийся при электролизе на катоде, присоединяет к себе определенное число электронов, например, ион серебра — один электрон, а ион меди — два электрона. Следовательно, заряд, перенесенный через электролит при прохождении тока, должен быть прямо пропорционален числу разрядившихся ионов. Поскольку массы ионов определенного вида точно одинаковы, то общая масса всех ионов пропорциональна их числу. А это означает, что масса выделенного при электролизе вещества должна быть прямо пропорциональна заряду, прошедшему через раствор, что соответствует закону Фарадея.
–ü–æ—Å–∫–æ–ª—å–∫—É –∏–æ–Ω—ã —Ä–∞–∑–ª–∏—á–Ω–æ–≥–æ –≤–∏–¥–∞ –∏–º–µ—é—Ç –Ω–µ–æ–¥–∏–Ω–∞–∫–æ–≤—É—é –º–∞—Å—Å—É (–Ω–∞–ø—Ä–∏–º–µ—Ä, –º–∞—Å—Å–∞ –Ω–æ–Ω–∞ —Å–µ—Ä–µ–±—Ä–∞ –≤ 107,9 —Ä–∞–∑–∞ –±–æ–ª—å—à–µ, —á–µ–º –º–∞—Å—Å–∞ –Ω–æ–Ω–∞ –≤–æ–¥–æ—Ä–æ–¥–∞), –º–∞—Å—Å–∞ –≤—ã–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–µ—â–µ—Å—Ç–≤–∞ –¥–æ–ª–∂–Ω–∞ –∑–∞–≤–∏—Å–µ—Ç—å –æ—Ç –µ–≥–æ —Ä–æ–¥–∞.
–õ–µ–∫—Ü–∏—è 1. –ó–∞–∫–æ–Ω—ã –§–∞—Ä–∞–¥–µ—è
1. –ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è — —Ñ—É–Ω–¥–∞–º–µ–Ω—Ç–∞–ª—å–Ω—ã–π –∫–æ–ª–∏—á–µ—Å—Ç–≤–µ–Ω–Ω—ã–π –∑–∞–∫–æ–Ω —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏–∏.
4. –í—ã—Ö–æ–¥ –≤–µ—â–µ—Å—Ç–≤–∞ –ø–æ —Ç–æ–∫—É.
5.–°–ø–æ—Å–æ–±—ã –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –≤—ã—Ö–æ–¥–∞ –ø–æ —Ç–æ–∫—É –ø—Ä–∏ –∏—Å–ø–æ–ª—å–∑–æ–≤–∞–Ω–∏–∏ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–≥–æ –∏ –∏–º–ø—É–ª—å—Å–Ω–æ–≥–æ —Ç–æ–∫–∞.
6.–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è.
7.–ö–∞–∂—É—â–∏–µ—Å—è —Å–ª—É—á–∞–∏ –æ—Ç–∫–ª–æ–Ω–µ–Ω–∏—è –æ—Ç –∑–∞–∫–æ–Ω–æ–≤ –§–∞—Ä–∞–¥–µ—è.
–û–≥–ª–∞–≤–ª–µ–Ω–∏–µ
1. –ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è : –ï—Å–ª–∏ –Ω–∞ –≥—Ä–∞–Ω–∏—Ü–µ —Ä–∞–∑–¥–µ–ª–∞ –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ I —Ä–æ–¥–∞ — –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ II —Ä–æ–¥–∞ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ –ø–æ—Å—Ç–æ—è–Ω–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ —Ç–æ–∫–∞ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –æ–¥–Ω–∞, –∏ —Ç–æ–ª—å–∫–æ –æ–¥–Ω–∞, —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∞—è —Ä–µ–∞–∫—Ü–∏—è, —Ç–æ –º–∞—Å—Å–∞ –∫–∞–∂–¥–æ–≥–æ –∏–∑ —É—á–∞—Å—Ç–Ω–∏–∫–æ–≤ —Ä–µ–∞–∫—Ü–∏–∏, –ø—Ä–µ—Ç–µ—Ä–ø–µ–≤—à–∏—Ö –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏–µ, –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤—É –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —á–µ—Ä–µ–∑ –≥—Ä–∞–Ω–∏—Ü—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞.
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è —É—Å—Ç–∞–Ω–∞–≤–ª–∏–≤–∞–µ—Ç —Å–≤—è–∑—å –º–µ–∂–¥—É –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ–º –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Å–∏—Å—Ç–µ–º—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ –∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ–º –ø—Ä–æ—Ä–µ–∞–≥–∏—Ä–æ–≤–∞–≤—à–µ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞.
где m – масса прореагировавшего вещества, г; k – электрохимический эквивалент, г/(А . час); I – постоянный ток, проходящий через границу раздела фаз, А; t – продолжительность прохождения тока, час.
или m = k . Q, где Q – количество прошедшего электричества (Q = I . t)
2. –≠–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç.
–≠–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –ø—Ä–µ–¥—Å—Ç–∞–≤–ª—è–µ—Ç —Å–æ–±–æ–π –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –≤–µ—â–µ—Å—Ç–≤–∞, –ø—Ä–æ—Ä–µ–∞–≥–∏—Ä–æ–≤–∞–≤—à–µ–≥–æ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –ø—Ä–æ—Ç–µ–∫–∞–Ω–∏—è –µ–¥–∏–Ω–∏—Ü—ã –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞.
–≠–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç –º–æ–∂–µ—Ç –±—ã—Ç—å –ø–æ–ª—É—á–µ–Ω —Ä–∞—Å—á–µ—Ç–Ω—ã–º –ø—É—Ç–µ–º, –µ—Å–ª–∏ –∏–∑–≤–µ—Å—Ç–Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∞—è —Ä–µ–∞–∫—Ü–∏—è, —Ç.–µ. –∏—Å—Ö–æ–¥–Ω—ã–µ –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –µ–µ –ø—Ä–æ–¥—É–∫—Ç—ã. –£—Ä–∞–≤–Ω–µ–Ω–∏–µ –¥–ª—è —Ä–∞—Å—á–µ—Ç–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞ –≤—ã–≥–ª—è–¥–∏—Ç —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º:
 ,
,
где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
3. –ö—É–ª–æ–Ω–æ–º–µ—Ç—Ä—ã. –ö–ª–∞—Å—Å–∏—Ñ–∏–∫–∞—Ü–∏—è –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–æ–≤.
–í —Å–µ—Ä–µ–±—Ä—è–Ω–æ–º –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–µ –æ–ø—Ä–µ–¥–µ–ª—è–µ—Ç—Å—è –º–∞—Å—Å–∞ —Å–µ—Ä–µ–±—Ä–∞, –≤—ã–¥–µ–ª—è—é—â–∞—è—Å—è
–∏–∑ –≤–æ–¥–Ω–æ–≥–æ —Ä–∞—Å—Ç–≤–æ—Ä–∞ –Ω–∏—Ç—Ä–∞—Ç–∞ —Å–µ—Ä–µ–±—Ä–∞. –ü–ª–∞—Ç–∏–Ω–æ–≤–∞—è —á–∞—à–∞ —Å–ª—É–∂–∏—Ç –ò–º–µ—é—Ç—Å—è —Å–∏—Å—Ç–µ–º—ã, –≤ –∫–æ—Ç–æ—Ä—ã—Ö –≤–µ—Å—å —Ç–æ–∫ —Ä–∞—Å—Ö–æ–¥—É–µ—Ç—Å—è —Ç–æ–ª—å–∫–æ –Ω–∞ –æ–¥–Ω—É —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Ä–µ–∞–∫—Ü–∏—é. –¢–∞–∫–∏–µ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —Å–∏—Å—Ç–µ–º—ã –∏—Å–ø–æ–ª—å–∑—É—é—Ç—Å—è –¥–ª—è –∏–∑–º–µ—Ä–µ–Ω–∏—è –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ –∏ –Ω–∞–∑—ã–≤–∞—é—Ç—Å—è –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞–º–∏ .
–ò–∑–≤–µ—Å—Ç–Ω—ã —Ç—Ä–∏ –æ—Å–Ω–æ–≤–Ω—ã—Ö —Ç–∏–ø–∞ –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–æ–≤: –≤–µ—Å–æ–≤—ã–µ (–≥—Ä–∞–≤–∏–º–µ—Ç—Ä–∏—á–µ—Å–∫–∏–µ), –æ–±—ä–µ–º–Ω—ã–µ (–≤–æ–ª—é–º–µ—Ç—Ä–∏—á–µ—Å–∫–∏–µ) –∏ —Ç–∏—Ç—Ä–∞—Ü–∏–æ–Ω–Ω—ã–µ .
–í –≤–µ—Å–æ–≤—ã—Ö –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞—Ö (–∫ –Ω–∏–º –æ—Ç–Ω–æ—Å—è—Ç—Å—è —Å–µ—Ä–µ–±—Ä—è–Ω—ã–µ –∏ –º–µ–¥–Ω—ã–µ) –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –ø—Ä–æ—à–µ–¥—à–µ–≥–æ –≤ –Ω–∏—Ö —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ —Ä–∞—Å—Å—á–∏—Ç—ã–≤–∞–µ—Ç—Å—è –ø–æ –∏–∑–º–µ–Ω–µ–Ω–∏—é –º–∞—Å—Å—ã –∫–∞—Ç–æ–¥–∞ –∏–ª–∏ –∞–Ω–æ–¥–∞. –í –æ–±—ä–µ–º–Ω—ã—Ö –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞—Ö —Ä–∞—Å—á–µ—Ç –ø—Ä–æ–∏–∑–≤–æ–¥–∏—Ç—Å—è –Ω–∞ –æ—Å–Ω–æ–≤–∞–Ω–∏–∏ –∏–∑–º–µ—Ä–µ–Ω–∏—è –æ–±—ä–µ–º–∞ –ø–æ–ª—É—á–∞—é—â–∏—Ö—Å—è –≤–µ—â–µ—Å—Ç–≤ (–≥–∞–∑–∞ –≤ –≤–æ–¥–æ—Ä–æ–¥–Ω–æ–º –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–µ, –∂–∏–¥–∫–æ–π —Ä—Ç—É—Ç–∏ –≤ —Ä—Ç—É—Ç–Ω–æ–º –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–µ). –í —Ç–∏—Ç—Ä–∞—Ü–∏–æ–Ω–Ω—ã—Ö–∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞—Ö –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ—ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ –æ–ø—Ä–µ–¥–µ–ª—è–µ—Ç—Å—è –ø–æ –¥–∞–Ω–Ω—ã–º —Ç–∏—Ç—Ä–æ–≤–∞–Ω–∏—è –≤–µ—â–µ—Å—Ç–≤, –æ–±—Ä–∞–∑—É—é—â–∏—Ö—Å—è –≤ —Ä–∞—Å—Ç–≤–æ—Ä–µ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —ç–ª–µ–∫—Ç—Ä–æ–¥–Ω–æ–π —Ä–µ–∞–∫—Ü–∏–∏.
–ú–µ–¥–Ω—ã–π –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä –Ω–∞–∏–±–æ–ª–µ–µ —Ä–∞—Å–ø—Ä–æ—Å—Ç—Ä–∞–Ω–µ–Ω –≤ –ø—Ä–∞–∫—Ç–∏–∫–µ –ª–∞–±–æ—Ä–∞—Ç–æ—Ä–Ω—ã—Ö –∏—Å—Å–ª–µ–¥–æ–≤–∞–Ω–∏–π, —Ç.–∫. –æ–Ω —è–≤–ª—è–µ—Ç—Å—è –ø—Ä–æ—Å—Ç—ã–º –≤ –∏–∑–≥–æ—Ç–æ–≤–ª–µ–Ω–∏–∏ –∏ –¥–æ—Å—Ç–∞—Ç–æ—á–Ω–æ —Ç–æ—á–Ω—ã–º. –¢–æ—á–Ω–æ—Å—Ç—å –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ —Å–æ—Å—Ç–∞–≤–ª—è–µ—Ç 0,1 %. –ö—É–ª–æ–Ω–æ–º–µ—Ç—Ä —Å–æ—Å—Ç–æ–∏—Ç –∏–∑ –¥–≤—É—Ö –º–µ–¥–Ω—ã—Ö –∞–Ω–æ–¥–æ–≤ –∏ –∫–∞—Ç–æ–¥–∞ –∏–∑ —Ç–æ–Ω–∫–æ–π –º–µ–¥–Ω–æ–π —Ñ–æ–ª—å–≥–∏, —Ä–∞—Å–ø–æ–ª–æ–∂–µ–Ω–Ω–æ–≥–æ –º–µ–∂–¥—É –Ω–∏–º–∏. –≠–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–æ–º –≤ –º–µ–¥–Ω–æ–º–∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–µ —Å–ª—É–∂–∏—Ç –≤–æ–¥–Ω—ã–π —Ä–∞—Å—Ç–≤–æ—Ä —Å–æ—Å—Ç–∞–≤–∞: CuSO4 ‚àô 5H2O, H2SO4 –∏ —ç—Ç–∞–Ω–æ–ª C2H5OH.–°–µ—Ä–Ω–∞—è –∫–∏—Å–ª–æ—Ç–∞ –ø–æ–≤—ã—à–∞–µ—Ç —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫—É—é –ø—Ä–æ–≤–æ–¥–∏–º–æ—Å—Ç—å —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞ –∏, –∫—Ä–æ–º–µ —Ç–æ–≥–æ, –ø—Ä–µ–ø—è—Ç—Å—Ç–≤—É–µ—Ç –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—é –æ—Å–Ω–æ–≤–Ω—ã—Ö —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–π –º–µ–¥–∏ –≤ –ø—Ä–∏–∫–∞—Ç–æ–¥–Ω–æ–º –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–µ, –∫–æ—Ç–æ—Ä—ã–µ –º–æ–≥—É—Ç –∞–¥—Å–æ—Ä–±–∏—Ä–æ–≤–∞—Ç—å—Å—è –Ω–∞ –∫–∞—Ç–æ–¥–µ, —É–≤–µ–ª–∏—á–∏–≤–∞—è —Ç–µ–º —Å–∞–º—ã–º –µ–≥–æ –º–∞—Å—Å—É. H2SO4–≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–µ –º–µ–¥–Ω–æ–≥–æ –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞ –Ω–µ–æ–±—Ö–æ–¥–∏–º–∞ –¥–ª—è –ø—Ä–µ–¥–æ—Ç–≤—Ä–∞—â–µ–Ω–∏—è –Ω–∞–∫–æ–ø–ª–µ–Ω–∏—è —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–π Cu 1+ , –∫–æ—Ç–æ—Ä—ã–µ –º–æ–≥—É—Ç –æ–±—Ä–∞–∑–æ–≤—ã–≤–∞—Ç—å—Å—è –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —Ä–µ–∞–∫—Ü–∏–∏ –¥–∏—Å–ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∏—Ä–æ–≤–∞–Ω–∏—è:
Cu 0 + Cu 2+ ‚Üí 2Cu +
–≠—Ç–∏–ª–æ–≤—ã–π —Å–ø–∏—Ä—Ç –¥–æ–±–∞–≤–ª—è—é—Ç –≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –¥–ª—è –ø–æ–ª—É—á–µ–Ω–∏—è –±–æ–ª–µ–µ –º–µ–ª–∫–æ–∫—Ä–∏—Å—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏—Ö, –∫–æ–º–ø–∞–∫—Ç–Ω—ã—Ö –∫–∞—Ç–æ–¥–Ω—ã—Ö –æ—Å–∞–¥–∫–æ–≤ –∏ —Å —Ü–µ–ª—å—é –ø—Ä–µ–¥–æ—Ç–≤—Ä–∞—â–µ–Ω–∏—è –æ–∫–∏—Å–ª–µ–Ω–∏—è –º–µ–¥–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–¥–æ–≤ –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–∞.
–û –∫–æ–ª–∏—á–µ—Å—Ç–≤–µ –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ —Å—É–¥—è—Ç –ø–æ –∏–∑–º–µ–Ω–µ–Ω–∏—é –º–∞—Å—Å—ã –∫–∞—Ç–æ–¥–∞, –¥–æ –∏ –ø–æ—Å–ª–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞.
–∫–∞—Ç–æ–¥–æ–º, –∞ –∞–Ω–æ–¥ –≥–æ—Ç–æ–≤–∏—Ç—Å—è –∏–∑ —á–∏—Å—Ç–æ–≥–æ —Å–µ—Ä–µ–±—Ä–∞.
–í –∫–∞—á–µ—Å—Ç–≤–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞ –≤ —Å–µ—Ä–µ–±—Ä—è–Ω–æ–º –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä–µ –∏—Å–ø–æ–ª—å–∑—É–µ—Ç—Å—è –Ω–µ–π—Ç—Ä–∞–ª—å–Ω—ã–π –∏–ª–∏ —Å–ª–∞–±–æ–∫–∏—Å–ª—ã–π 30% —Ä–∞—Å—Ç–≤–æ—Ä –Ω–∏—Ç—Ä–∞—Ç–∞ —Å–µ—Ä–µ–±—Ä–∞.
–ì–∞–∑–æ–≤—ã–π –≤–æ–¥–æ—Ä–æ–¥–Ω–æ-–∫–∏—Å–ª–æ—Ä–æ–¥–Ω—ã–π –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä –ø—Ä–∏–º–µ–Ω—è–µ—Ç—Å—è –¥–ª—è –ø—Ä–∏–±–ª–∏–∂–µ–Ω–Ω—ã—Ö –∏–∑–º–µ—Ä–µ–Ω–∏–π –º–∞–ª—ã—Ö –∫–æ–ª–∏—á–µ—Å—Ç–≤ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞. –í –Ω–µ–º –∏–∑–º–µ—Ä—è—é—Ç –æ–±—â–∏–π –æ–±—ä–µ–º –≤–æ–¥–æ—Ä–æ–¥–∞ –∏ –∫–∏—Å–ª–æ—Ä–æ–¥–∞, –≤—ã–¥–µ–ª—è—é—â–∏—Ö—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–æ–¥–Ω–æ–≥–æ —Ä–∞—Å—Ç–≤–æ—Ä–∞ H2SO4–∏–ª–∏ NaOH, –∞ –∏–∑ —ç—Ç–æ–π –≤–µ–ª–∏—á–∏–Ω—ã –≤—ã—á–∏—Å–ª—è—é—Ç –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞. –ü—Ä–∏–º–µ–Ω—è—é—Ç —ç—Ç–∏ –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä—ã —Å—Ä–∞–≤–Ω–∏—Ç–µ–ª—å–Ω–æ —Ä–µ–¥–∫–æ, —Ç.–∫. —Ç–æ—á–Ω–æ—Å—Ç—å –∏—Ö –Ω–µ–±–æ–ª—å—à–∞—è, –∞ –≤ —Ä–∞–±–æ—Ç–µ –æ–Ω–∏ –º–µ–Ω–µ–µ —É–¥–æ–±–Ω—ã, —á–µ–º –≤–µ—Å–æ–≤—ã–µ –∫—É–ª–æ–Ω–æ–º–µ—Ç—Ä—ã.
К объемным кулонометрам относится также ртутный кулонометр . Он применяется главным образом в промышленности для измерений количества электричества. Точность ртутного кулонометра составляет 1%, но он может работать при больших плотностях тока. Анодом служит ртуть. Уголь – катод. Электролитом служит раствор иодида ртути и иодида калия. По уровню ртути в трубке рассчитывают количество электричества.
Наиболее распространенные из титрационныхкулонометров – йодный
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиновоиридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
–ö—É–ª–æ–Ω–æ–º–µ—Ç—Ä –ö–∏—Å—Ç—è–∫–æ–≤—Å–∫–æ–≥–æ — —ç—Ç–æ —Å—Ç–µ–∫–ª—è–Ω–Ω—ã–π —Å–æ—Å—É–¥. –ê–Ω–æ–¥–æ–º —Å–ª—É–∂–∏—Ç —Å–µ—Ä–µ–±—Ä—è–Ω–∞—è –ø—Ä–æ–≤–æ–ª–æ–∫–∞, –≤–ø–∞—è–Ω–Ω–∞—è –≤ —Å—Ç–µ–∫–ª—è–Ω–Ω—É—é —Ç—Ä—É–±–∫—É —Å–æ —Ä—Ç—É—Ç—å—é, –¥–ª—è –æ–±–µ—Å–ø–µ—á–µ–Ω–∏—è –∫–æ–Ω—Ç–∞–∫—Ç–∞. –°–æ—Å—É–¥ –∑–∞–ø–æ–ª–Ω—è—é—Ç —Ä–∞—Å—Ç–≤–æ—Ä–æ–º –Ω–∏—Ç—Ä–∞—Ç–∞ –∫–∞–ª–∏—è (15-20%). –í —ç—Ç–æ—Ç —Ä–∞—Å—Ç–≤–æ—Ä –ø–æ–≥—Ä—É–∂–∞—é—Ç –ø–ª–∞—Ç–∏–Ω–æ–≤–æ–∏—Ä–∏–¥–∏–µ–≤—ã–π –∫–∞—Ç–æ–¥. –ü—Ä–∏ –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏–∏ —Ç–æ–∫–∞ –ø—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç –∞–Ω–æ–¥–Ω–æ–µ —Ä–∞—Å—Ç–≤–æ—Ä–µ–Ω–∏–µ —Å–µ—Ä–µ–±—Ä–∞. –ò —Ç–∞–∫–∂–µ –ø–æ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–∞–º —Ç–∏—Ç—Ä–æ–≤–∞–Ω–∏—è —Ä–∞—Å—Ç–≤–æ—Ä–∞ —Ä–∞—Å—Å—á–∏—Ç—ã–≤–∞—é—Ç –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞.
4. –í—ã—Ö–æ–¥ –ø–æ —Ç–æ–∫—É
–ß–∞—Å—Ç–æ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –Ω–µ –æ–¥–Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∞—è —Ä–µ–∞–∫—Ü–∏—è, –∞ –Ω–µ—Å–∫–æ–ª—å–∫–æ —Å–∞–º–æ—Å—Ç–æ—è—Ç–µ–ª—å–Ω—ã—Ö –ø–∞—Ä–∞–ª–ª–µ–ª—å–Ω—ã—Ö —Ä–µ–∞–∫—Ü–∏–π. –ù–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ –≤—ã–¥–µ–ª–µ–Ω–∏–∏ Zn –∏–∑ –∫–∏—Å–ª–æ–≥–æ —Ä–∞—Å—Ç–≤–æ—Ä–∞ ZnSO4–Ω–∞—Ä—è–¥—É —Å —Ä–∞–∑—Ä—è–¥–æ–º –∏–æ–Ω–æ–≤ Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
–ï—Å–ª–∏ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –Ω–µ—Å–∫–æ–ª—å–∫–æ–ø–∞—Ä–∞–ª–ª–µ–ª—å–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏—Ö —Ä–µ–∞–∫—Ü–∏–π, —Ç–æ I –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –±—É–¥–µ—Ç —Å–ø—Ä–∞–≤–µ–¥–ª–∏–≤ –¥–ª—è –∫–∞–∂–¥–æ–π –∏–∑ –Ω–∏—Ö.
–î–ª—è –ø—Ä–∞–∫—Ç–∏—á–µ—Å–∫–∏—Ö —Ü–µ–ª–µ–π, –¥–ª—è —Ç–æ–≥–æ, —á—Ç–æ–±—ã —É—á–µ—Å—Ç—å –∫–∞–∫–∞—è –¥–æ–ª—è —Ç–æ–∫–∞ –∏–ª–∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Å–∏—Å—Ç–µ–º—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ —Ä–∞—Å—Ö–æ–¥—É–µ—Ç—Å—è –Ω–∞ –∫–∞–∂–¥—É—é –∫–æ–Ω–∫—Ä–µ—Ç–Ω—É—é —Ä–µ–∞–∫—Ü–∏—é –≤–≤–µ–¥–µ–Ω–æ –ø–æ–Ω—è—Ç–∏–µ –≤—ã—Ö–æ–¥–∞ –≤–µ—â–µ—Å—Ç–≤–∞ –ø–æ —Ç–æ–∫—É.
–¢–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º, –í–¢ –ø–æ–∑–≤–æ–ª—è–µ—Ç –æ–ø—Ä–µ–¥–µ–ª–∏—Ç—å —á–∞—Å—Ç—å –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Å–∏—Å—Ç–µ–º—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞, –∫–æ—Ç–æ—Ä–∞—è –ø—Ä–∏—Ö–æ–¥–∏—Ç—Å—è –Ω–∞ –¥–æ–ª—é –¥–∞–Ω–Ω–æ–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–π —Ä–µ–∞–∫—Ü–∏–∏.
–ó–Ω–∞–Ω–∏–µ –í–¢ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ, –∫–∞–∫ –ø—Ä–∏ —Ä–µ—à–µ–Ω–∏–∏ —Ç–µ–æ—Ä–µ—Ç–∏—á–µ—Å–∫–∏—Ö –≤–æ–ø—Ä–æ—Å–æ–≤: –Ω–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ –ø–æ—Å—Ç—Ä–æ–µ–Ω–∏–∏ –ø–∞—Ä—Ü–∏–∞–ª—å–Ω—ã—Ö –ø–æ–ª—è—Ä–∏–∑–∞—Ü–∏–æ–Ω–Ω—ã—Ö –∫—Ä–∏–≤—ã—Ö –∏ –≤—ã—è—Å–Ω–µ–Ω–∏–∏ –º–µ—Ö–∞–Ω–∏–∑–º–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–π —Ä–µ–∞–∫—Ü–∏–∏, —Ç–∞–∫ –∏ –≤ –ø—Ä–∞–∫—Ç–∏–∫–µ —ç–ª–µ–∫—Ç—Ä–æ–æ—Å–∞–∂–¥–µ–Ω–∏—è –º–µ—Ç–∞–ª–ª–æ–≤, –Ω–µ–º–µ—Ç–∞–ª–ª–æ–≤, —Å–ø–ª–∞–≤–æ–≤, —Å —Ü–µ–ª—å—é –æ—Ü–µ–Ω–∫–∏ —ç—Ñ—Ñ–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç–∏ —Ç–µ—Ö–Ω–æ–ª–æ–≥–∏—á–µ—Å–∫–æ–π –æ–ø–µ—Ä–∞—Ü–∏–∏. –í–¢ –Ω–∞ –ø—Ä–∞–∫—Ç–∏–∫–µ —á–∞—â–µ –≤—Å–µ–≥–æ –æ–ø—Ä–µ–¥–µ–ª—è—é—Ç –¥–µ–ª–µ–Ω–∏–µ–º –ø—Ä–∞–∫—Ç–∏—á–µ—Å–∫–æ–π –º–∞—Å—Å—ã –≤–µ—â–µ—Å—Ç–≤–∞ –Ω–∞ —Ç–µ–æ—Ä–µ—Ç–∏—á–µ—Å–∫—É—é –º–∞—Å—Å—É, –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω—É—é –ø–æ –∑–∞–∫–æ–Ω—É –§–∞—Ä–∞–¥–µ—è.
m–ø—Ä–∞–∫—Ç ‚Äì –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –ø—Ä–∞–∫—Ç–∏—á–µ—Å–∫–∏ –ø—Ä–µ–≤—Ä–∞—Ç–∏–≤—à–µ–≥–æ—Å—è –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–Ω–æ–≥–æ –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞; m—Ç–µ–æ—Ä — –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –∫–æ—Ç–æ—Ä–∞—è –¥–æ–ª–∂–Ω–∞ –ø—Ä–µ–≤—Ä–∞—Ç–∏—Ç—å—Å—è —Ç–µ–æ—Ä–µ—Ç–∏—á–µ—Å–∫–∏ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ —Ç–æ–≥–æ –∂–µ –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞.
–í–¢ –¥–ª—è –ø—Ä–æ—Ü–µ—Å—Å–æ–≤, –ø—Ä–æ—Ç–µ–∫–∞—é—â–∏—Ö –Ω–∞ –∫–∞—Ç–æ–¥–µ, –∫–∞–∫ –ø—Ä–∞–≤–∏–ª–æ, –Ω–µ —Å–æ–≤–ø–∞–¥–∞—é—Ç —Å –í–¢ –∞–Ω–æ–¥–Ω—ã—Ö –ø—Ä–æ—Ü–µ—Å—Å–æ–≤, –ø–æ—ç—Ç–æ–º—É —Å–ª–µ–¥—É–µ—Ç —Ä–∞–∑–ª–∏—á–∞—Ç—å –∫–∞—Ç–æ–¥–Ω—ã–π –∏ –∞–Ω–æ–¥–Ω—ã–π –≤—ã—Ö–æ–¥ –ø–æ —Ç–æ–∫—É. –î–æ —Å–∏—Ö –ø–æ—Ä –±—ã–ª–∏ —Ä–∞—Å—Å–º–æ—Ç—Ä–µ–Ω—ã —Å–ª—É—á–∞–∏ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –í–¢ –∫–æ–≥–¥–∞ —á–µ—Ä–µ–∑ –≥—Ä–∞–Ω–∏—Ü—É —Ä–∞–∑–¥–µ–ª–∞ –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ I —Ä–æ–¥–∞ — –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ II —Ä–æ–¥–∞ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –ø–æ—Å—Ç–æ—è–Ω–Ω—ã–π —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–π —Ç–æ–∫.
5. –°–ø–æ—Å–æ–±—ã –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –í–¢ –ø—Ä–∏ –∏—Å–ø–æ–ª—å–∑–æ–≤–∞–Ω–∏–∏ –∏–º–ø—É–ª—å—Å–Ω–æ–≥–æ —Ç–æ–∫–∞
–ï—Å–ª–∏ –∂–µ —á–µ—Ä–µ–∑ –≥—Ä–∞–Ω–∏—Ü—É —Ä–∞–∑–¥–µ–ª–∞ —Ñ–∞–∑ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –∏–º–ø—É–ª—å—Å–Ω—ã–π —Ç–æ–∫, —Ç–æ –ø—Ä–∏ –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏–∏ –í–¢ –≤–æ–∑–Ω–∏–∫–∞—é—Ç –±–æ–ª—å—à–∏–µ —Ç—Ä—É–¥–Ω–æ—Å—Ç–∏. –ï–¥–∏–Ω–æ–π –º–µ—Ç–æ–¥–∏–∫–∏ –∏–ª–∏ –ø—Ä–∏–±–æ—Ä–∞ –¥–ª—è –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –í–¢ –ø—Ä–∏ –∏–º–ø—É–ª—å—Å–Ω–æ–º—ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –Ω–µ —Å—É—â–µ—Å—Ç–≤—É–µ—Ç. –°–ª–æ–∂–Ω–æ—Å—Ç—å –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –í–¢ –≤ —É—Å–ª–æ–≤–∏—è—Ö –∏–º–ø—É–ª—å—Å–Ω–æ–≥–æ—ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ –æ–±—É—Å–ª–æ–≤–ª–µ–Ω–∞ —Ç–µ–º, —á—Ç–æ –ø—Ä–æ—Ö–æ–¥—è—â–∏–π —á–µ—Ä–µ–∑ —Å–∏—Å—Ç–µ–º—É —Ç–æ–∫ —Ä–∞—Å—Ö–æ–¥—É–µ—Ç—Å—è –Ω–µ —Ç–æ–ª—å–∫–æ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Ä–µ–∞–∫—Ü–∏—é, –Ω–æ –∏ –Ω–∞ –∑–∞—Ä—è–∂–µ–Ω–∏–µ –¥–≤–æ–π–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ —Å–ª–æ—è. –≠–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–π —Ç–æ–∫, –ø—Ä–æ—Ö–æ–¥—è—â–∏–π —á–µ—Ä–µ–∑ –≥—Ä–∞–Ω–∏—Ü—É —Ä–∞–∑–¥–µ–ª–∞ –∏ –≤—ã–∑—ã–≤–∞—é—â–∏–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–µ –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏–µ, –Ω–∞–∑—ã–≤–∞–µ—Ç—Å—è —á–∞—Å—Ç–æ —Ñ–∞—Ä–∞–¥–µ–µ–≤—Å–∫–∏–º —Ç–æ–∫–æ–º. –¢–æ–∫ –∑–∞—Ä—è–∂–µ–Ω–∏—è —Ä–∞—Å—Ö–æ–¥—É–µ—Ç—Å—è –Ω–∞ –∑–∞—Ä—è–∂–µ–Ω–∏–µ –¥–≤–æ–π–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ —Å–ª–æ—è, —Ä–µ–æ—Ä–≥–∞–Ω–∏–∑–∞—Ü–∏—é —Ä–∞—Å—Ç–≤–æ—Ä–∏—Ç–µ–ª—è, —Å–∞–º–æ–≥–æ —Ä–µ–∞–≥–µ–Ω—Ç–∞, —Ç.–µ. –Ω–∞ –≤—Å–µ –Ω–∞ —Ç–æ, —á—Ç–æ —Å–æ–∑–¥–∞–µ—Ç —É—Å–ª–æ–≤–∏—è –¥–ª—è –ø—Ä–æ—Ç–µ–∫–∞–Ω–∏—è —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–π —Ä–µ–∞–∫—Ü–∏–∏, –ø–æ—ç—Ç–æ–º—É –≤—ã—Ä–∞–∂–µ–Ω–∏–µ –¥–ª—è –æ–±—â–µ–≥–æ —Ç–æ–∫–∞, –ø—Ä–æ—Ö–æ–¥—è—â–µ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫—É—é —Å–∏—Å—Ç–µ–º—É, –±—É–¥–µ—Ç –≤—ã–≥–ª—è–¥–µ—Ç—å —Å–ª–µ–¥—É—é—â–∏–º –æ–±—Ä–∞–∑–æ–º:
I = Iз + Iф, где Iз – ток заряжения, Iф – фарадеевский ток.
–ï—Å–ª–∏ –Ω–µ —Ç—Ä–µ–±—É–µ—Ç—Å—è –æ–ø—Ä–µ–¥–µ–ª–µ–Ω–∏—è –∞–±—Å–æ–ª—é—Ç–Ω—ã—Ö –∑–Ω–∞—á–µ–Ω–∏–π –í–¢, —Ç–æ –≤ –∫–∞—á–µ—Å—Ç–≤–µ –∫—Ä–∏—Ç–µ—Ä–∏—è –æ—Ü–µ–Ω–∫–∏ —ç—Ñ—Ñ–µ–∫—Ç–∏–≤–Ω–æ—Å—Ç–∏ –∏–º–ø—É–ª—å—Å–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ –º–æ–∂–Ω–æ –∏—Å–ø–æ–ª—å–∑–æ–≤–∞—Ç—å –æ—Ç–Ω–æ—à–µ–Ω–∏—è –∫–æ–ª–∏—á–µ—Å—Ç–≤–∞ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞, –∑–∞—Ç—Ä–∞—á–µ–Ω–Ω–æ–≥–æ –Ω–∞ —Ä–∞—Å—Ç–≤–æ—Ä–µ–Ω–∏–µ –æ—Å–∞–¥–∫–∞ –∫ –∫–æ–ª–∏—á–µ—Å—Ç–≤—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞, –∑–∞—Ç—Ä–∞—á–µ–Ω–Ω–æ–≥–æ –Ω–∞ –µ–≥–æ —Ñ–æ—Ä–º–∏—Ä–æ–≤–∞–Ω–∏–µ.
6. –í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è.
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è —è–≤–ª—è–µ—Ç—Å—è –Ω–µ–ø–æ—Å—Ä–µ–¥—Å—Ç–≤–µ–Ω–Ω—ã–º —Å–ª–µ–¥—Å—Ç–≤–∏–µ–º –ø–µ—Ä–≤–æ–≥–æ –∑–∞–∫–æ–Ω–∞. –í–æ –≤—Ç–æ—Ä–æ–º –∑–∞–∫–æ–Ω–µ –§–∞—Ä–∞–¥–µ—è –æ—Ç—Ä–∞–∂–µ–Ω–∞ —Å–≤—è–∑—å, —Å—É—â–µ—Å—Ç–≤—É—é—â–∞—è –º–µ–∂–¥—É –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ–º –ø—Ä–æ—Ä–µ–∞–≥–∏—Ä–æ–≤–∞–≤—à–µ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –µ–≥–æ —Ö–∏–º–∏—á–µ—Å–∫–æ–π –ø—Ä–∏—Ä–æ–¥–æ–π.
–°–æ–≥–ª–∞—Å–Ω–æ –≤—Ç–æ—Ä–æ–º—É –∑–∞–∫–æ–Ω—É –§–∞—Ä–∞–¥–µ—è:
–ï—Å–ª–∏ –Ω–∞ –≥—Ä–∞–Ω–∏—Ü–µ —Ä–∞–∑–¥–µ–ª–∞ –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ I —Ä–æ–¥–∞ — –ø—Ä–æ–≤–æ–¥–Ω–∏–∫ II —Ä–æ–¥–∞ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –æ–¥–Ω–∞ –∏ —Ç–æ–ª—å–∫–æ –æ–¥–Ω–∞, —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∞—è —Ä–µ–∞–∫—Ü–∏—è, –≤ –∫–æ—Ç–æ—Ä–æ–π —É—á–∞—Å—Ç–≤—É–µ—Ç –Ω–µ—Å–∫–æ–ª—å–∫–æ –≤–µ—â–µ—Å—Ç–≤, —Ç–æ –º–∞—Å—Å—ã —É—á–∞—Å—Ç–Ω–∏–∫–æ–≤ —Ä–µ–∞–∫—Ü–∏–∏, –ø—Ä–µ—Ç–µ—Ä–ø–µ–≤—à–∏—Ö –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏—è, –æ—Ç–Ω–æ—Å—è—Ç—Å—è –¥—Ä—É–≥ –∫ –¥—Ä—É–≥—É –∫–∞–∫ –∏—Ö —Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã.
–ú–∞—Ç–µ–º–∞—Ç–∏—á–µ—Å–∫–∏ —ç—Ç–æ—Ç –∑–∞–∫–æ–Ω –≤—ã—Ä–∞–∂–∞–µ—Ç—Å—è —É—Ä–∞–≤–Ω–µ–Ω–∏–µ–º:
7. –ö–∞–∂—É—â–∏–µ—Å—è —Å–ª—É—á–∞–∏ –æ—Ç–∫–ª–æ–Ω–µ–Ω–∏—è –æ—Ç –∑–∞–∫–æ–Ω–æ–≤ –§–∞—Ä–∞–¥–µ—è
I –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è , –±–∞–∑–∏—Ä—É—é—â–∏–π—Å—è –Ω–∞ –∞—Ç–æ–º–∏—Å—Ç–∏—á–µ—Å–∫–æ–π –ø—Ä–∏—Ä–æ–¥–µ –≤–µ—â–µ—Å—Ç–≤–∞ –∏ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞, —è–≤–ª—è–µ—Ç—Å—è —Ç–æ—á–Ω—ã–º –∑–∞–∫–æ–Ω–æ–º –ø—Ä–∏—Ä–æ–¥—ã. –û—Ç–∫–ª–æ–Ω–µ–Ω–∏–π –æ—Ç –Ω–µ–≥–æ –±—ã—Ç—å –Ω–µ –º–æ–∂–µ—Ç. –ï—Å–ª–∏ –Ω–∞ –ø—Ä–∞–∫—Ç–∏–∫–µ –ø—Ä–∏ —Ä–∞—Å—á–µ—Ç–∞—Ö –Ω–∞–±–ª—é–¥–∞—é—Ç—Å—è –æ—Ç–∫–ª–æ–Ω–µ–Ω–∏—è –æ—Ç —ç—Ç–æ–≥–æ –∑–∞–∫–æ–Ω–∞, —Ç–æ –æ–Ω–∏ –≤—Å–µ–≥–¥–∞ –æ–±—É—Å–ª–æ–≤–ª–µ–Ω—ã –Ω–µ–ø–æ–ª–Ω—ã–º —É—á–µ—Ç–æ–º –ø—Ä–æ—Ü–µ—Å—Å–æ–≤, —Å–æ–ø—É—Ç—Å—Ç–≤—É—é—â–∏—Ö –æ—Å–Ω–æ–≤–Ω–æ–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–π —Ä–µ–∞–∫—Ü–∏–∏. –ù–∞–ø—Ä–∏–º–µ—Ä, –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –≤–æ–¥–Ω–æ–≥–æ —Ä–∞—Å—Ç–≤–æ—Ä–∞ NaCl –≤ —Å–∏—Å—Ç–µ–º–µ —Å –ø–ª–∞—Ç–∏–Ω–æ–≤—ã–º–∏ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞–º–∏ –∏ —Ä–∞–∑–¥–µ–ª–µ–Ω–Ω—ã–º–∏ –ø–æ—Ä–∏—Å—Ç–æ–π –¥–∏–∞—Ñ—Ä–∞–≥–º–æ–π –∞–Ω–æ–¥–Ω—ã–º –∏ –∫–∞—Ç–æ–¥–Ω—ã–º –ø—Ä–æ—Å—Ç—Ä–∞–Ω—Å—Ç–≤–∞–º–∏ –Ω–∞ –∫–∞—Ç–æ–¥–µ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç —Ä–µ–∞–∫—Ü–∏—è:
–∞ –Ω–∞ –∞–Ω–æ–¥–µ: 2Cl — — 2ƒì = Cl2
–ö–æ–ª–∏—á–µ—Å—Ç–≤–æ –æ–±—Ä–∞–∑—É—é—â–µ–≥–æ—Å—è –≥–∞–∑–æ–æ–±—Ä–∞–∑–Ω–æ–≥–æ —Ö–ª–æ—Ä–∞ –≤—Å–µ–≥–¥–∞ –º–µ–Ω—å—à–µ, —á–µ–º —ç—Ç–æ —Å–ª–µ–¥—É–µ—Ç –ø–æ –∑–∞–∫–æ–Ω—É –§–∞—Ä–∞–¥–µ—è –∏–∑-–∑–∞ —Ç–æ–≥–æ, —á—Ç–æ Cl2—Ä–∞—Å—Ç–≤–æ—Ä—è–µ—Ç—Å—è –≤ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–µ –∏ –≤—Å—Ç—É–ø–∞–µ—Ç –≤ —Ä–µ–∞–∫—Ü–∏—é –≥–∏–¥—Ä–æ–ª–∏–∑–∞:
–ï—Å–ª–∏ —É—á–µ—Å—Ç—å –º–∞—Å—Å—É —Ö–ª–æ—Ä–∞, –ø—Ä–æ—Ä–µ–∞–≥–∏—Ä–æ–≤–∞–≤—à–µ–≥–æ —Å –≤–æ–¥–æ–π, –ø–æ–ª—É—á–∏–º —Ä–µ–∑—É–ª—å—Ç–∞—Ç, —Å–æ–æ—Ç–≤–µ—Ç—Å—Ç–≤—É—é—â–∏–π —Ä–∞—Å—Å—á–∏—Ç–∞–Ω–Ω–æ–º—É –ø–æ –∑–∞–∫–æ–Ω—É –§–∞—Ä–∞–¥–µ—è.
–ò–ª–∏ –ø—Ä–∏ –∞–Ω–æ–¥–Ω–æ–º —Ä–∞—Å—Ç–≤–æ—Ä–µ–Ω–∏–∏ –º–Ω–æ–≥–∏—Ö –º–µ—Ç–∞–ª–ª–æ–≤ –ø–∞—Ä–∞–ª–ª–µ–ª—å–Ω–æ –∏–¥—É—Ç –¥–≤–∞ –ø—Ä–æ—Ü–µ—Å—Å–∞ ‚Äì –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏–µ –∏–æ–Ω–æ–≤ –Ω–æ—Ä–º–∞–ª—å–Ω–æ–π –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ –∏ —Ç–∞–∫ –Ω–∞–∑—ã–≤–∞–µ–º—ã—Ö —Å—É–±–∏–æ–Ω–æ–≤ ‚Äì —Ç.–µ. –∏–æ–Ω–æ–≤ –Ω–∏–∑—à–µ–π –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏, –Ω–∞–ø—Ä–∏–º–µ—Ä: Cu 0 — 2ƒì ‚Üí Cu 2+ –∏
Cu- 1ē → Cu + . Поэтому расчет по закону Фарадея в предположении, что образуются только ионы высшей валентности, оказывается неправильным.
–ï—Å–ª–∏ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä–æ—Ç–µ–∫–∞–µ—Ç –Ω–µ—Å–∫–æ–ª—å–∫–æ –ø–∞—Ä–∞–ª–ª–µ–ª—å–Ω—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏—Ö —Ä–µ–∞–∫—Ü–∏–π, —Ç–æ I –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –±—É–¥–µ—Ç —Å–ø—Ä–∞–≤–µ–¥–ª–∏–≤ –¥–ª—è –∫–∞–∂–¥–æ–π –∏–∑ –Ω–∏—Ö.
1 2 –∑–∞–∫–æ–Ω —Ñ–∞—Ä–∞–¥–µ—è
–≠—Ç–∏ –∑–∞–∫–æ–Ω—ã –æ–ø—Ä–µ–¥–µ–ª—è—é—Ç —Å–æ–æ—Ç–Ω–æ—à–µ–Ω–∏–µ –º–µ–∂–¥—É –º–∞—Å—Å–æ–π –ø—Ä–æ–¥—É–∫—Ç–∞, –æ–±—Ä–∞–∑—É—é—â–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ, –∏ –∫–æ–ª–∏—á–µ—Å—Ç–≤–æ–º —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ (—ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–º –∑–∞—Ä—è–¥–æ–º), –ø—Ä–æ–ø—É—â–µ–Ω–Ω—ã–º —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç.
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –≥–ª–∞—Å–∏—Ç, —á—Ç–æ –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –æ–±—Ä–∞–∑—É—é—â–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ, –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤—É –ø—Ä–æ–ø—É—â–µ–Ω–Ω–æ–≥–æ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞. –ö–æ–ª–∏—á–µ—Å—Ç–≤–µ–Ω–Ω–æ–π –º–µ—Ä–æ–π —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ –∑–∞—Ä—è–¥–∞ —è–≤–ª—è–µ—Ç—Å—è –µ–¥–∏–Ω–∏—Ü–∞ —Ñ–∞—Ä–∞–¥–µ–π. –§–∞—Ä–∞–¥–µ–π — —ç—Ç–æ –∑–∞—Ä—è–¥, –∫–æ—Ç–æ—Ä—ã–π –Ω–µ—Å–µ—Ç –Ω–∞ —Å–µ–±–µ –æ–¥–∏–Ω –º–æ–ª—å —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤ –∏–ª–∏ –æ–¥–∏–Ω –º–æ–ª—å –æ–¥–Ω–æ–∑–∞—Ä—è–¥–Ω—ã—Ö –∏–æ–Ω–æ–≤.

Напомним, что число  — это число Авогадро (см. разд. 4.2).
— это число Авогадро (см. разд. 4.2).
–Ý–∞–∑—Ä—è–¥ –∏–æ–Ω–æ–≤ —Å–µ—Ä–µ–±—Ä–∞ –Ω–∞ –∫–∞—Ç–æ–¥–µ –≤ –ø—Ä–æ—Ü–µ—Å—Å–µ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ —Ä–∞—Å—Ç–≤–æ—Ä–∞ –Ω–∏—Ç—Ä–∞—Ç–∞ —Å–µ—Ä–µ–±—Ä–∞ –æ–ø–∏—Å—ã–≤–∞–µ—Ç—Å—è —É—Ä–∞–≤–Ω–µ–Ω–∏–µ–º –ø–æ–ª—É—Ä–µ–∞–∫—Ü–∏–∏

–°–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ, —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–∏–π –∑–∞—Ä—è–¥ –≤ 1 —Ñ–∞—Ä–∞–¥–µ–π (–æ–¥–∏–Ω –º–æ–ª—å —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤) —Ä–∞–∑—Ä—è–∂–∞–µ—Ç 1 –º–æ–ª—å –∏–æ–Ω–æ–≤ —Å–µ—Ä–µ–±—Ä–∞, –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —á–µ–≥–æ –æ–±—Ä–∞–∑—É–µ—Ç—Å—è 1 –º–æ–ª—å –∞—Ç–æ–º–æ–≤ —Å–µ—Ä–µ–±—Ä–∞. –≠—Ç–æ –æ–∑–Ω–∞—á–∞–µ—Ç, —á—Ç–æ –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏–µ –∑–∞—Ä—è–¥–∞ –≤ 2 —Ñ–∞—Ä–∞–¥–µ—è –ø—Ä–∏–≤–µ–¥–µ—Ç –∫ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—é 2 –º–æ–ª–µ–π –∞—Ç–æ–º–æ–≤ —Å–µ—Ä–µ–±—Ä–∞, –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏–µ 3 —Ñ–∞—Ä–∞–¥–µ–µ–≤ –∑–∞—Ä—è–¥–∞ –ø—Ä–∏–≤–µ–¥–µ—Ç –∫ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—é 3 –º–æ–ª–µ–π –∞—Ç–æ–º–æ–≤ —Å–µ—Ä–µ–±—Ä–∞ –∏ —Ç.–¥.
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –≥–ª–∞—Å–∏—Ç, —á—Ç–æ –¥–ª—è —Ä–∞–∑—Ä—è–¥–∞ –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –∫–∞–∫–æ–≥–æ-–ª–∏–±–æ –∏–æ–Ω–∞ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç —Ç–∞–∫–æ–µ —á–∏—Å–ª–æ —Ñ–∞—Ä–∞–¥–µ–µ–≤ –∑–∞—Ä—è–¥–∞, –∫–æ—Ç–æ—Ä–æ–µ —Ä–∞–≤–Ω–æ —á–∏—Å–ª—É —ç–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω—ã—Ö –∑–∞—Ä—è–¥–æ–≤ –Ω–∞ —ç—Ç–æ–º –∏–æ–Ω–µ.

 –º–æ–ª—å 2 –º–æ–ª—è 1 –º–æ–ª—å –¢–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º, –¥–ª—è —Ä–∞–∑—Ä—è–¥–∞ –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –∏–æ–Ω–æ–≤
–º–æ–ª—å 2 –º–æ–ª—è 1 –º–æ–ª—å –¢–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º, –¥–ª—è —Ä–∞–∑—Ä—è–¥–∞ –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –∏–æ–Ω–æ–≤  –Ω–∞ –∫–∞—Ç–æ–¥–µ —á–µ—Ä–µ–∑ –Ω–µ–≥–æ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å 2 —Ñ–∞—Ä–∞–¥–µ—è –∑–∞—Ä—è–¥–∞ (2 –º–æ–ª—è —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤).
–Ω–∞ –∫–∞—Ç–æ–¥–µ —á–µ—Ä–µ–∑ –Ω–µ–≥–æ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å 2 —Ñ–∞—Ä–∞–¥–µ—è –∑–∞—Ä—è–¥–∞ (2 –º–æ–ª—è —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤).

 –º–æ–ª—å 3 –º–æ–ª—è I –º–æ–ª—å
–º–æ–ª—å 3 –º–æ–ª—è I –º–æ–ª—å
–î–ª—è —Ä–∞–∑—Ä—è–¥–∞ –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –∏–æ–Ω–æ–≤ –∞–ª—é–º–∏–Ω–∏—è –Ω–∞ –∫–∞—Ç–æ–¥–µ —á–µ—Ä–µ–∑ –Ω–µ–≥–æ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å 3 —Ñ–∞—Ä–∞–¥–µ—è –∑–∞—Ä—è–¥–∞ (3 –º–æ–ª—è —ç–ª–µ–∫—Ç—Ä–æ–Ω–æ–≤).

 –º–æ–ª—è 1 –º–æ–ª—å 2 –º–æ–ª—è
–º–æ–ª—è 1 –º–æ–ª—å 2 –º–æ–ª—è
–î–ª—è –ø–æ–ª—É—á–µ–Ω–∏—è –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –º–æ–ª–µ–∫—É–ª –±—Ä–æ–º–∞ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —Ä–∞–∑—Ä—è–¥–∞ –¥–≤—É—Ö –º–æ–ª–µ–π –∏–æ–Ω–æ–≤ –±—Ä–æ–º–∞ –Ω–∞ –∞–Ω–æ–¥–µ —á–µ—Ä–µ–∑ –Ω–µ–≥–æ –Ω–µ–æ–±—Ö–æ–¥–∏–º–æ –ø—Ä–æ–ø—É—Å—Ç–∏—Ç—å 2 —Ñ–∞—Ä–∞–¥–µ—è –∑–∞—Ä—è–¥–∞. –°–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ, –¥–ª—è —Ä–∞–∑—Ä—è–¥–∞ –æ–¥–Ω–æ–≥–æ –º–æ–ª—è –∏–æ–Ω–æ–≤ –±—Ä–æ–º–∞ –Ω–µ–æ–±—Ö–æ–¥–∏–º –æ–¥–∏–Ω —Ñ–∞—Ä–∞–¥–µ–π –∑–∞—Ä—è–¥–∞.
–í—ã—á–∏—Å–ª–∏–º –º–∞—Å—Å—É —Å–≤–∏–Ω—Ü–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ –∫–∞—Ç–æ–¥–µ –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –ø—Ä–æ–ø—É—Å–∫–∞–Ω–∏—è —Ç–æ–∫–∞ —Å–∏–ª–æ–π 2 –ê —á–µ—Ä–µ–∑ —Ä–∞—Å–ø–ª–∞–≤–ª–µ–Ω–Ω—ã–π –±—Ä–æ–º–∏–¥  –≤ —Ç–µ—á–µ–Ω–∏–µ 30 –º–∏–Ω
–≤ —Ç–µ—á–µ–Ω–∏–µ 30 –º–∏–Ω 
–í—ã–¥–µ–ª–µ–Ω–∏–µ —Å–≤–∏–Ω—Ü–∞ –Ω–∞ –∫–∞—Ç–æ–¥–µ –ø—Ä–æ–∏—Å—Ö–æ–¥–∏—Ç –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ —Å–ª–µ–¥—É—é—â–µ–π –ø–æ–ª—É—Ä–µ–∞–∫—Ü–∏–∏:

–ò—Ç–∞–∫, 2 —Ñ–∞—Ä–∞–¥–µ—è –∑–∞—Ä—è–¥–∞ (—Ç. –µ. 2-96 500 –ö–ª) –ø–æ–∑–≤–æ–ª—è—é—Ç –ø–æ–ª—É—á–∏—Ç—å 1 –º–æ–ª—å –∞—Ç–æ–º–æ–≤ –Ý–¨ (—Ç. –µ. 207 –≥ –∞—Ç–æ–º–æ–≤ –Ý–¨). –û—Ç—Å—é–¥–∞

–£—á—Ç–µ–º —Ç–µ–ø–µ—Ä—å, —á—Ç–æ —Ç–æ–∫ —Å–∏–ª–æ–π 2 –ê, –ø—Ä–æ—Ç–µ–∫–∞—è –≤ —Ç–µ—á–µ–Ω–∏–µ 30 –º–∏–Ω, –ø–µ—Ä–µ–Ω–æ—Å–∏—Ç –∑–∞—Ä—è–¥, —Ä–∞–≤–Ω—ã–π 2-30-60 –ö–ª. –°–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ,

–ú–∞–π–∫–ª –§–∞—Ä–∞–¥–µ–π (1791-1867)
–ê–Ω–≥–ª–∏–π—Å–∫–∏–π —Ö–∏–º–∏–∫ –∏ —Ñ–∏–∑–∏–∫ –ú–∞–π–∫–ª –§–∞—Ä–∞–¥–µ–π –±—ã–ª –≤—ã–¥–∞—é—â–∏–º—Å—è —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞—Ç–æ—Ä–æ–º –∏ –ø—Ä–æ—Å–ª–∞–≤–∏–ª—Å—è –∫–∞–∫ –æ–¥–∏–Ω –∏–∑ –ø–µ—Ä–≤—ã—Ö –∏—Å—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª–µ–π –ø—Ä–∏—Ä–æ–¥—ã —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ –∏ –º–∞–≥–Ω–µ—Ç–∏–∑–º–∞.
–§–∞—Ä–∞–¥–µ–π –Ω–µ —Å–º–æ–≥ –ø–æ–ª—É—á–∏—Ç—å –≤ –¥–µ—Ç—Å—Ç–≤–µ —Å–∏—Å—Ç–µ–º–∞—Ç–∏—á–µ—Å–∫–æ–≥–æ –æ–±—Ä–∞–∑–æ–≤–∞–Ω–∏—è. –í –≤–æ–∑—Ä–∞—Å—Ç–µ 14 –ª–µ—Ç –æ–Ω —Å—Ç–∞–ª –ø–æ–º–æ—â–Ω–∏–∫–æ–º –ø–µ—Ä–µ–ø–ª–µ—Ç—á–∏–∫–∞. –ù–æ –≤—Å–∫–æ—Ä–µ –æ–Ω –∑–∞–∏–Ω—Ç–µ—Ä–µ—Å–æ–≤–∞–ª—Å—è –Ω–∞—É–∫–æ–π –∏, –ø—Ä–æ—Å–ª—É—à–∞–≤ –ª–µ–∫—Ü–∏—é –∑–Ω–∞–º–µ–Ω–∏—Ç–æ–≥–æ —Ö–∏–º–∏–∫–∞ –ì–µ–º—Ñ—Ä–∏ –î—ç–≤–∏, –Ω–∞–ø–∏—Å–∞–ª –µ–º—É –∏ –æ—Ç–ø—Ä–∞–≤–∏–ª —Å–≤–æ–∏ –∑–∞–ø–∏—Å–∏ –ª–µ–∫—Ü–∏–∏. –î—ç–≤–∏ –ø—Ä–∏–Ω—è–ª –µ–≥–æ –∞—Å—Å–∏—Å—Ç–µ–Ω—Ç–æ–º –≤ —Å–≤–æ—é –ª–∞–±–æ—Ä–∞—Ç–æ—Ä–∏—é –≤ –ö–æ—Ä–æ–ª–µ–≤—Å–∫–æ–º –∏–Ω—Å—Ç–∏—Ç—É—Ç–µ –≤ –õ–æ–Ω–¥–æ–Ω–µ. –§–∞—Ä–∞–¥–µ—é –±—ã–ª–æ –≤ —Ç–æ –≤—Ä–µ–º—è 21 –≥–æ–¥.

–ú–∞–π–∫–ª –§–∞—Ä–∞–¥–µ–π —á–∏—Ç–∞–µ—Ç —Ä–æ–∂–¥–µ—Å—Ç–≤–µ–Ω—Å–∫—É—é –ª–µ–∫—Ü–∏—é –≤ –ö–æ—Ä–æ–ª–µ–≤—Å–∫–æ–º –∏–Ω—Å—Ç–∏—Ç—É—Ç–µ (–õ–æ–Ω–¥–æ–Ω, 1955 –≥.) –≤ –ø—Ä–∏—Å—É—Ç—Å—Ç–≤–∏–∏ —á–ª–µ–Ω–æ–≤ –∫–æ—Ä–æ–ª–µ–≤—Å–∫–æ–π —Å–µ–º—å–∏: –ª–∏—Ü–æ–º –∫ –Ω–µ–º—É –≤ –ø–µ—Ä–≤–æ–º —Ä—è–¥—É — –º—É–∂ –∫–æ—Ä–æ–ª–µ–≤—ã, —Å–ª–µ–≤–∞ –æ—Ç –Ω–µ–≥–æ — –ø—Ä–∏–Ω—Ü –£—ç–ª—å—Å–∫–∏–π (–≤–ø–æ—Å–ª–µ–¥—Å—Ç–≤–∏–∏ –≠–¥—É–∞—Ä–¥ VII), —Å–ø—Ä–∞–≤–∞ –æ—Ç –Ω–µ–≥–æ — –≥–µ—Ä—Ü–æ–≥ –≠–¥–∏–Ω–±—É—Ä–≥—Å–∫–∏–π.
–í –ø–æ—Å–ª–µ–¥—É—é—â–∏–µ –≥–æ–¥—ã –§–∞—Ä–∞–¥–µ–π –æ—Ç–∫—Ä—ã–ª –¥–≤–∞ –Ω–æ–≤—ã—Ö —Ö–ª–æ—Ä–∏–¥–∞ —É–≥–ª–µ—Ä–æ–¥–∞. –ï–º—É —É–¥–∞–ª–æ—Å—å —Ç–∞–∫–∂–µ –ø–µ—Ä–µ–≤–µ—Å—Ç–∏ –≤ –∂–∏–¥–∫–æ–µ —Å–æ—Å—Ç–æ—è–Ω–∏–µ —Ö–ª–æ—Ä –∏ –¥—Ä—É–≥–∏–µ –≥–∞–∑—ã. –í 1825 –≥. –æ–Ω —Å—É–º–µ–ª –≤—ã–¥–µ–ª–∏—Ç—å –±–µ–Ω–∑–æ–ª –∏ –≤ —Ç–æ–º –∂–µ –≥–æ–¥—É –±—ã–ª –Ω–∞–∑–Ω–∞—á–µ–Ω –∑–∞–≤–µ–¥—É—é—â–∏–º –ª–∞–±–æ—Ä–∞—Ç–æ—Ä–∏–µ–π. –í —Ç–µ—á–µ–Ω–∏–µ –Ω–µ—Å–∫–æ–ª—å–∫–∏—Ö –ª–µ—Ç –æ–Ω –∑–∞–Ω–∏–º–∞–ª—Å—è —ç–∫—Å–ø–µ—Ä–∏–º–µ–Ω—Ç–∞–ª—å–Ω—ã–º –∏–∑—É—á–µ–Ω–∏–µ–º —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ –∏ –≤ –∫–æ–Ω—Ü–µ –∫–æ–Ω—Ü–æ–≤ —Å—Ñ–æ—Ä–º—É–ª–∏—Ä–æ–≤–∞–ª –≤ 1834 –≥. —Å–≤–æ–∏ –∑–Ω–∞–º–µ–Ω–∏—Ç—ã–µ –∑–∞–∫–æ–Ω—ã —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞. –ö —ç—Ç–æ–º—É –≤—Ä–µ–º–µ–Ω–∏ –æ–Ω —É–∂–µ –æ—Ç–∫—Ä—ã–ª —è–≤–ª–µ–Ω–∏–µ —ç–ª–µ–∫—Ç—Ä–æ–º–∞–≥–Ω–∏—Ç–Ω–æ–π –∏–Ω–¥—É–∫—Ü–∏–∏.
Фарадей стал президентом Королевского общества и написал несколько книг, в том числе «Экспериментальные исследования по химии и физике» (1858). В 1855 г. из-за ухудшения памяти он вынужден был прекратить исследовательскую работу. В 1867 г. Фарадей умер.
–ó–∞–∫–æ–Ω—ã –§–∞—Ä–∞–¥–µ—è –∫–æ–ª–∏—á–µ—Å—Ç–≤–µ–Ω–Ω–æ –æ–ø–∏—Å—ã–≤–∞—é—Ç –∑–∞–∫–æ–Ω–æ–º–µ—Ä–Ω–æ—Å—Ç–∏, –Ω–∞–±–ª—é–¥–∞—é—â–∏–µ—Å—è –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ — –ø—Ä–æ—Ü–µ—Å—Å–µ –ø—Ä–µ–≤—Ä–∞—â–µ–Ω–∏—è —Ä–∞–∑–ª–∏—á–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å–∫–æ–≥–æ —Ç–æ–∫–∞ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç. –û–Ω–∏ –æ—Ç–∫—Ä—ã—Ç—ã –≤ 1833-34 –≥–≥. –∞–Ω–≥–ª–∏–π—Å–∫–∏–º —É—á–µ–Ω—ã–º –ú. –§–∞—Ä–∞–¥–µ–µ–º (M. Faraday, 1791 — 1867) –≤ —Ä–µ–∑—É–ª—å—Ç–∞—Ç–µ –∞–Ω–∞–ª–∏–∑–∞ –æ–ø—ã—Ç–Ω—ã—Ö –¥–∞–Ω–Ω—ã—Ö, –ø–æ–ª—É—á–µ–Ω–Ω—ã—Ö –∏–º –ø—Ä–∏ –∏–∑—É—á–µ–Ω–∏–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤.
–ü–µ—Ä–≤—ã–π –∑–∞–∫–æ–Ω: –º–∞—Å—Å–∞ m –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ, –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–∞ –∫–æ–ª–∏—á–µ—Å—Ç–≤—É —ç–ª–µ–∫—Ç—Ä–∏—á–µ—Å—Ç–≤–∞ (–∑–∞—Ä—è–¥—É Q ), –ø—Ä–æ—à–µ–¥—à–µ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç: m = kQ , –≥–¥–µ k — –∫–æ—ç—Ñ—Ñ–∏—Ü–∏–µ–Ω—Ç –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω–æ—Å—Ç–∏, –Ω–∞–∑—ã–≤–∞–µ–º—ã–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–æ–º –≤–µ—â–µ—Å—Ç–≤–∞ –∏ –∑–∞–≤–∏—Å—è—â–∏–π –æ—Ç –ø—Ä–∏—Ä–æ–¥—ã –≤–µ—â–µ—Å—Ç–≤–∞. –û–Ω —á–∏—Å–ª–µ–Ω–Ω–æ —Ä–∞–≤–µ–Ω –º–∞—Å—Å–µ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ –∑–∞—Ä—è–¥–∞, —Ä–∞–≤–Ω–æ–≥–æ 1 –ö–ª, –∏ –≤—ã—Ä–∞–∂–∞–µ—Ç—Å—è –≤ –∫–≥/–ö–ª. –≠–ª–µ–º–µ–Ω—Ç—ã, –ø—Ä–æ—è–≤–ª—è—é—â–∏–µ –≤ —Ö–∏–º–∏—á–µ—Å–∫–∏—Ö —Å–æ–µ–¥–∏–Ω–µ–Ω–∏—è—Ö —Ä–∞–∑–ª–∏—á–Ω—É—é –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å, –∏–º–µ—é—Ç –Ω–µ—Å–∫–æ–ª—å–∫–æ –∑–Ω–∞—á–µ–Ω–∏–π —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–æ–≥–æ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞.
–í—Ç–æ—Ä–æ–π –∑–∞–∫–æ–Ω: —ç–ª–µ–∫—Ç—Ä–æ—Ö–∏–º–∏—á–µ—Å–∫–∏–µ —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç—ã —Ä–∞–∑–ª–∏—á–Ω—ã—Ö –≤–µ—â–µ—Å—Ç–≤ –ø—Ä—è–º–æ –ø—Ä–æ–ø–æ—Ä—Ü–∏–æ–Ω–∞–ª—å–Ω—ã –∏—Ö —Ö–∏–º–∏—á–µ—Å–∫–∏–º —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç–∞–º:
 ,
,
–≥–¥–µ A / n — —Ö–∏–º–∏—á–µ—Å–∫–∏–π —ç–∫–≤–∏–≤–∞–ª–µ–Ω—Ç;
A — –∞—Ç–æ–º–Ω–∞—è –∏–ª–∏ –º–æ–ª–µ–∫—É–ª—è—Ä–Ω–∞—è –º–∞—Å—Å–∞ –∏–æ–Ω–æ–≤, –Ω–µ–π—Ç—Ä–∞–ª–∏–∑—É—é—â–∏—Ö—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ;
n — –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å –∏–æ–Ω–∞;
F — –Ω–µ–∫–æ—Ç–æ—Ä–∞—è –ø–æ—Å—Ç–æ—è–Ω–Ω–∞—è –≤–µ–ª–∏—á–∏–Ω–∞, –Ω–∞–∑—ã–≤–∞–µ–º–∞—è —á–∏—Å–ª–æ–º –§–∞—Ä–∞–¥–µ—è, –æ–¥–∏–Ω–∞–∫–æ–≤–∞—è –¥–ª—è –≤—Å–µ—Ö –≤–µ—â–µ—Å—Ç–≤ ( –æ–¥–Ω–æ–≤–∞–ª–µ–Ω—Ç–Ω—ã—Ö).
–ó–∞–∫–æ–Ω—ã –§–∞—Ä–∞–¥–µ—è –º–æ–∂–Ω–æ –≤—ã—Ä–∞–∑–∏—Ç—å –æ–¥–Ω–∏–º —Å–æ–æ—Ç–Ω–æ—à–µ–Ω–∏–µ–º — –æ–±—ä–µ–¥–∏–Ω–µ–Ω–Ω—ã–º –∑–∞–∫–æ–Ω–æ–º –§–∞—Ä–∞–¥–µ—è:
 ,
,
–≥–¥–µ I — —Å–∏–ª–∞ —Ç–æ–∫–∞;
t — –≤—Ä–µ–º—è –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏—è —Ç–æ–∫–∞.
–ò–∑ –æ–±—ä–µ–¥–∏–Ω–µ–Ω–Ω–æ–≥–æ –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è —Å–ª–µ–¥—É–µ—Ç, —á—Ç–æ —á–∏—Å–ª–æ –§–∞—Ä–∞–¥–µ—è —Ä–∞–≤–Ω–æ –∑–∞—Ä—è–¥—É, –ø—Ä–∏ –ø—Ä–æ—Ö–æ–∂–¥–µ–Ω–∏–∏ –∫–æ—Ç–æ—Ä–æ–≥–æ —á–µ—Ä–µ–∑ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ –≤—ã–¥–µ–ª—è–µ—Ç—Å—è 1 –º–æ–ª—å –≤–µ—â–µ—Å—Ç–≤–∞ –≤ —Ä–∞—Å—á–µ—Ç–µ –Ω–∞ –µ–¥–∏–Ω–∏—Ü—É –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç–∏ —ç—Ç–æ–≥–æ –≤–µ—â–µ—Å—Ç–≤–∞. –û–ø—ã—Ç–Ω—ã–º –ø—É—Ç–µ–º –±—ã–ª–æ —É—Å—Ç–∞–Ω–æ–≤–ª–µ–Ω–æ, —á—Ç–æ F = 96,5 –∫–ö–ª/–º–æ–ª—å.
–û–±—ä–µ–¥–∏–Ω–µ–Ω–Ω—ã–π –∑–∞–∫–æ–Ω –§–∞—Ä–∞–¥–µ—è –º–æ–∂–Ω–æ –≤—ã–≤–µ—Å—Ç–∏, –∏—Å—Ö–æ–¥—è –∏–∑ –ø—Ä–µ–¥—Å—Ç–∞–≤–ª–µ–Ω–∏–π –æ —Ç–æ–º, —á—Ç–æ –∫–∞–∂–¥—ã–π –∏–æ–Ω –ø—Ä–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–µ –ø–µ—Ä–µ–Ω–æ—Å–∏—Ç –∑–∞—Ä—è–¥ q , –∫—Ä–∞—Ç–Ω—ã–π –Ω–µ–∫–æ—Ç–æ—Ä–æ–º—É —ç–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω–æ–º—É –∑–∞—Ä—è–¥—É –µ : q = n –µ , –≥–¥–µ n — –≤–∞–ª–µ–Ω—Ç–Ω–æ—Å—Ç—å –∏–æ–Ω–∞. –ü–æ–ª–Ω—ã–π –∑–∞—Ä—è–¥, –ø–µ—Ä–µ–Ω–µ—Å–µ–Ω–Ω—ã–π N –∏–æ–Ω–∞–º–∏, —Ä–∞–≤–µ–Ω: Q = Nq = N n e . –ï—Å–ª–∏ m –æ — –º–∞—Å—Å–∞ –æ–¥–Ω–æ–≥–æ –∏–æ–Ω–∞, —Ç–æ –≤—Å—è –º–∞—Å—Å–∞ –≤–µ—â–µ—Å—Ç–≤–∞, –≤—ã–¥–µ–ª–∏–≤—à–µ–≥–æ—Å—è –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–µ:
 ,
,
где N А = 6,023·10 23 моль -1 .
–¢–∞–∫–∏–º –æ–±—Ä–∞–∑–æ–º, –º—ã –ø–æ–ª—É—á–∞–µ–º –æ–±—ä–µ–¥–∏–Ω–µ–Ω–Ω—ã–π –∑–∞–∫–æ–Ω.
–ü—Ä–∏ —ç—Ç–æ–º —á–∏—Å–ª–æ –§–∞—Ä–∞–¥–µ—è –æ–∫–∞–∑—ã–≤–∞–µ—Ç—Å—è —Ä–∞–≤–Ω—ã–º F = N A e. –ò–º–µ–Ω–Ω–æ –ø–æ —ç—Ç–æ–π —Ñ–æ—Ä–º—É–ª–µ –µ—â–µ –≤ 1874 –≥. –±—ã–ª –≤—ã—á–∏—Å–ª–µ–Ω —ç–ª–µ–º–µ–Ω—Ç–∞—Ä–Ω—ã–π –∑–∞—Ä—è–¥ — –∑–∞—Ä—è–¥ —ç–ª–µ–∫—Ç—Ä–æ–Ω–∞:
e = 96,5 –ß 10 3 /(6,023 –ß 10 23 ) = 1,6 –ß 10 -19 –ö–ª.
–ó–∞–∫–æ–Ω—ã –§–∞—Ä–∞–¥–µ—è –±—ã–ª–∏ –ø—Ä–æ–≤–µ—Ä–µ–Ω—ã –≤ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö —É—Å–ª–æ–≤–∏—è—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞: –ø—Ä–∏ –±–æ–ª—å—à–∏—Ö –∏ –º–∞–ª—ã—Ö —Å–∏–ª–∞—Ö —Ç–æ–∫–∞, –ø—Ä–∏ –≤—ã—Å–æ–∫–∏—Ö –∏ –Ω–∏–∑–∫–∏—Ö —Ç–µ–º–ø–µ—Ä–∞—Ç—É—Ä–∞—Ö, –ø—Ä–∏ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö –¥–∞–≤–ª–µ–Ω–∏—è—Ö, –ø—Ä–∏ –æ–¥–Ω–æ–≤—Ä–µ–º–µ–Ω–Ω–æ–º –≤—ã–¥–µ–ª–µ–Ω–∏–∏ –Ω–µ—Å–∫–æ–ª—å–∫–∏—Ö –≤–µ—â–µ—Å—Ç–≤ –Ω–∞ —ç–ª–µ–∫—Ç—Ä–æ–¥–∞—Ö, –ø—Ä–∏ –ø—Ä–æ–≤–µ–¥–µ–Ω–∏–∏ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏–∑–∞ –≤ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö —Ä–∞—Å—Ç–≤–æ—Ä–∏—Ç–µ–ª—è—Ö –∏ –≤ —Ä–∞—Å–ø–ª–∞–≤–∞—Ö, –ø—Ä–∏ —Ä–∞–∑–ª–∏—á–Ω—ã—Ö –∫–æ–Ω—Ü–µ–Ω—Ç—Ä–∞—Ü–∏—è—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞. –û—Ç–∫–ª–æ–Ω–µ–Ω–∏—è –æ—Ç –∑–∞–∫–æ–Ω–∞ –§–∞—Ä–∞–¥–µ—è, –∫–æ—Ç–æ—Ä—ã–µ –∏–Ω–æ–≥–¥–∞ –Ω–∞–±–ª—é–¥–∞—é—Ç—Å—è, –æ–±—ä—è—Å–Ω—è—é—Ç—Å—è —Ç–µ–º, —á—Ç–æ –≤ –Ω–µ–∫–æ—Ç–æ—Ä—ã—Ö —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∞—Ö –∫—Ä–æ–º–µ –∏–æ–Ω–Ω–æ–π –ø—Ä–æ–≤–æ–¥–∏–º–æ—Å—Ç–∏ –ø—Ä–∏—Å—É—Ç—Å—Ç–≤—É–µ—Ç –µ—â–µ –∏ —ç–ª–µ–∫—Ç—Ä–æ–Ω–Ω–∞—è –ø—Ä–æ–≤–æ–¥–∏–º–æ—Å—Ç—å.
Электролиз широко используется в промышленности для производства различных веществ: хлора (мировой объем » 30 млн. тонн в год), щелочи ( » 35млн. тонн в год), алюминия ( » 15 млн. тонн в год). Он также используется для рафинирования металлов (степень чистоты 99,9 %); для синтеза некоторых органических соединений; в гальванопластике для получения слоев металлов достаточной толщины с целью воспроизводства формы предмета; в гальваностегии для получения тонких слоев с целью защиты от коррозии, для повышения износостойкости, в декоративных целях.
–°—Ö–µ–º–∞ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∏—á–µ—Å–∫–æ–π —É—Å—Ç–∞–Ω–æ–≤–∫–∏ –ø–æ–∫–∞–∑–∞–Ω–∞ –Ω–∞ —Ä–∏—Å. 1.
–°—Ö–µ–º–∞ —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç–∏—á–µ—Å–∫–æ–π —É—Å—Ç–∞–Ω–æ–≤–∫–∏
–í –Ω–µ–∫–æ—Ç–æ—Ä–æ–π –µ–º–∫–æ—Å—Ç–∏ –Ω–∞—Ö–æ–¥–∏—Ç—Å—è —ç–ª–µ–∫—Ç—Ä–æ–ª–∏—Ç –∏ –ø—Ä–æ–≤–æ–¥—è—â–∏–µ —ç–ª–µ–∫—Ç—Ä–æ–¥—ã —Ä–∞–∑–ª–∏—á–Ω–æ–π —Ñ–æ—Ä–º—ã (–º–µ—Ç–∞–ª–ª–∏—á–µ—Å–∫–∏–µ –∏–ª–∏ –≥—Ä–∞—Ñ–∏—Ç–æ–≤—ã–µ). –≠–ª–µ–∫—Ç—Ä–æ–¥—ã –ø–æ–¥–∫–ª—é—á–µ–Ω—ã –∫ –∏—Å—Ç–æ—á–Ω–∏–∫—É —Ç–æ–∫–∞. –î–ª—è –∏–∑–º–µ—Ä–µ–Ω–∏—è —Å–∏–ª—ã —Ç–æ–∫–∞ –∏—Å–ø–æ–ª—å–∑—É–µ—Ç—Å—è –∞–º–ø–µ—Ä–º–µ—Ç—Ä (–ê), –∞ –¥–ª—è –∏–∑–º–µ—Ä–µ–Ω–∏—è –Ω–∞–ø—Ä—è–∂–µ–Ω–∏—è — –≤–æ–ª—å—Ç–º–µ—Ç—Ä (V). –ü–ª–æ—Ç–Ω–æ—Å—Ç—å —Ç–æ–∫–∞ j = I / S , –≥–¥–µ I — —Å–∏–ª–∞ —Ç–æ–∫–∞, –∞ S — –ø–ª–æ—â–∞–¥—å —ç–ª–µ–∫—Ç—Ä–æ–¥–æ–≤. –í –∑–∞–≤–∏—Å–∏–º–æ—Å—Ç–∏ –æ—Ç –ø–ª–æ—â–∞–¥–∏ —ç–ª–µ–∫—Ç—Ä–æ–¥–æ–≤ –ø–ª–æ—Ç–Ω–æ—Å—Ç—å —Ç–æ–∫–∞ –º–æ–∂–µ—Ç —Å–æ—Å—Ç–∞–≤–ª—è—Ç—å (10 — 10 4 ) –ê / –º 2 . –ù–∞–ø—Ä—è–∂–µ–Ω–∏–µ –Ω–∞ –≤–∞–Ω–Ω–µ (2 — 5) –í. –ü—Ä–∏ –ø–æ—Å–ª–µ–¥–æ–≤–∞—Ç–µ–ª—å–Ω–æ–º —Å–æ–µ–¥–∏–Ω–µ–Ω–∏–∏ –Ω–µ—Å–∫–æ–ª—å–∫–∏—Ö –≤–∞–Ω–Ω –Ω–∞–ø—Ä—è–∂–µ–Ω–∏–µ —Å–æ—Å—Ç–∞–≤–ª—è–µ—Ç (200 — 400) –í. –í –ø—Ä–æ–º—ã—à–ª–µ–Ω–Ω—ã—Ö —ç–ª–µ—Ç—Ä–æ–ª–∏–∑–µ—Ä–∞—Ö —Ç–æ–∫ –º–æ–∂–µ—Ç –¥–æ—Å—Ç–∏–≥–∞—Ç—å 100 –∫–ê.
 1. –§–∏–∑–∏—á–µ—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è.- –ú.: –ë–æ–ª—å—à–∞—è –Ý–æ—Å—Å–∏–π—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è, 1998.- –¢.5.
1. –§–∏–∑–∏—á–µ—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è.- –ú.: –ë–æ–ª—å—à–∞—è –Ý–æ—Å—Å–∏–π—Å–∫–∞—è —ç–Ω—Ü–∏–∫–ª–æ–ø–µ–¥–∏—è, 1998.- –¢.5.
 2. –ö–∏—Ä–µ–µ–≤ –í.–ê. –ö—É—Ä—Å —Ñ–∏–∑–∏—á–µ—Å–∫–∏–π —Ö–∏–º–∏–∏.- –ú.: –•–∏–º–∏—è, 1975.
2. –ö–∏—Ä–µ–µ–≤ –í.–ê. –ö—É—Ä—Å —Ñ–∏–∑–∏—á–µ—Å–∫–∏–π —Ö–∏–º–∏–∏.- –ú.: –•–∏–º–∏—è, 1975.