Закон шарля решение задач
Примеры решения задач к главе «Уравнение состояния идеального газа. Газовые законы»
В задачах на использование газовых законов встречаются обычно следующие ситуации:
а) известны макроскопические параметры в начальном состоянии газа и некоторые параметры в конечном состоянии.
Если при переходе из начального состояния в конечное один из параметров не меняется, то при изотермическом процессе можно пользоваться законом Бойля-Мариотта в форме (3.6) или в эквивалентной форме 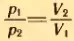 , следующей из (З.6). При изобарном процессе нужно пользоваться законом Гей-Люссака (3.8) или (3.7); при изохорном – законом Шарля (3.10) или (3.9).
, следующей из (З.6). При изобарном процессе нужно пользоваться законом Гей-Люссака (3.8) или (3.7); при изохорном – законом Шарля (3.10) или (3.9).
Если меняются все три параметра, то надо использовать уравнение состояния (3.4) или (3.5);
б) известна часть макроскопических параметров в определенном состоянии газа. Надо найти неизвестные величины. В этих случаях удобнее всего пользоваться уравнением Менделеева-Клапейрона (3.4);
в) во многих задачах требуется построение графиков, изображавших разного рода процессы. Для построения графиков нужно знать зависимость параметров друг от друга. Эта зависимость в общем случае дается уравнением состояния, а в частных случаях – газовыми законами.
При решении всех задач надо четко представлять себе, каково начальное состояние системы и какого рода процесс переводит ее в конечное состояние.
1. Баллон вместимостью V1 = 0,02 м 3 , содержавший воздух под давлением p1 = 4 * 10 5 Па, соединяют с баллоном вместимостью V2 = 0,06 м 3 , из которого воздух выкачан. Найти давление p , установившееся в сосудах. Температура постоянна.
Решение . Воздух из первого баллона займет весь предоставленный ему объем V1 + V2. По закону Бойля-Мариотта
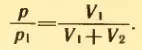
Отсюда искомое давление равно:

2. На какую долю первоначального объема увеличится объем газа, находящегося при температуре t = 27°C, если нагреть его на 1°C при постоянном давлении?
Решение . Пусть V1 и T1 = 273 К + t = 300 К – первоначальные значения параметров состояния газа, V2 и T2 = T1 + 1 К – конечные значения тех же параметров.
По закону Гей-Люссака
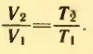
Равенство не изменится, если из левой и правой частей вычесть по единице:
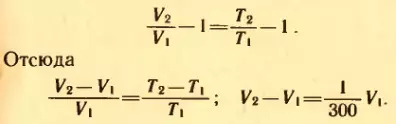
Объем газа увеличится на 1/300 долю первоначального.
3. Плотность воздуха при нормальных условиях (т. е. при t0 = 0°C и нормальном атмосферном давлении p0 = 101325 Па) ρ = 1,29 кг/м 3 . Найти среднюю молярную массу M воздуха.
Решение . Уравнение состояния идеального газа при нормальных условиях имеет вид:
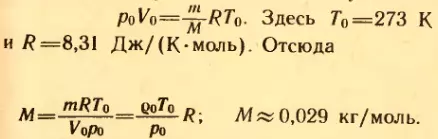
 4. Построить изобары для 2 г водорода при нормальном атмосферном давлении p0 в осях p, T; p, V; V, T.
4. Построить изобары для 2 г водорода при нормальном атмосферном давлении p0 в осях p, T; p, V; V, T.
Решение . На графиках зависимости p от T и p от V изобара будет представлять собой прямую, параллельную либо оси T, либо оси V (рис. 37, а и б).

§ 3.12. Примеры решения задач
Задачи на применение газовых законов очень разнообразны. Для их решения нельзя указать какой-либо один определенный прием. Полезными могут оказаться следующие советы.
1. Если согласно условию задачи один из трех параметров (р, V или Т) постоянный, то при Т = const надо применять закон Бойля—Мариотта (3.5.2), при р = const — закон Гей-Люссака (3.7.7), а при V = const — закон Шарля (3.10.2) или (3.10.3).
2. Если изменяются все три параметра, то следует воспользоваться уравнением состояния в форме (3.9.9) или (3.9.5).
Уравнение состояния (3.9.9) применяется в тех случаях, когда известна масса газа и часть макроскопических параметров в определенном состоянии газа и надо найти неизвестные величины.
3. Для определения давления смеси газов, не вступающих в химические реакции, используют закон Дальтона (3.8.2).
4. Во многих задачах требуется построение графиков, изображающих разного рода процессы. Для этого нужно знать зависимость параметров друг от друга, которая в общем случае дается уравнением состояния, а в частных — газовыми законами.
5. При решении большинства задач надо четко представлять себе, каково начальное состояние системы и какой процесс переводит его в конечное состояние.
Как измерить медицинским термометром температуру тела человека, если температура окружающего воздуха +42 °С?
Решение. Можно предварительно охладить термометр в холодильнике. Если холодильника нет, то нужно подержать термометр 5—8 мин под мышкой, извлечь его и сразу же стряхнуть. Термометр покажет температуру тела, так как ртуть в термометре сожмется при контакте с телом до объема, соответствующего температуре тела.
Газ в цилиндрическом сосуде разделен на две равные части подвижным поршнем, имеющим массу т и площадь сечения S. При горизонтальном положении цилиндра давление газа в каждой половине сосуда равно р. Определите давление газа над поршнем при вертикальном положении цилиндра. Температуру газа считать постоянной.
Решение. При горизонтальном положении цилиндра объем каждой его части обозначим через V (эти объемы равны). При вертикальном положении цилиндра объем верхней части станет равным V + ΔV, а нижней V — ΔV. Давление в нижней части цилиндра станет равным  Согласно закону Бойля—Мариотта
Согласно закону Бойля—Мариотта

Исключив из этих равенств  получим квадратное уравнение для p1:
получим квадратное уравнение для p1:

Второй корень квадратного уравнения отрицателен и потому лишен физического смысла.
Поршневой насос при каждом качании захватывает воздух объемом V0. При откачке этим насосом воздуха из сосуда объемом V насос совершил п качаний. Затем другой насос с тем же рабочим объемом V0 начал нагнетать воздух из атмосферы в тот же сосуд, совершив также п качаний. Какое давление установится в сосуде? Температуру воздуха во время работы насоса считать постоянной.
Решение. Согласно закону Бойля—Мариотта при откачке воздуха из сосуда после первого качания давление в сосуде станет равным  где р0 — атмосферное давление. После второго качания будет выполняться равенство р2V = p2(V + V0) и, следовательно,
где р0 — атмосферное давление. После второго качания будет выполняться равенство р2V = p2(V + V0) и, следовательно,  и т. д. После n качании в сосуде установится давление
и т. д. После n качании в сосуде установится давление 
При нагнетании воздуха в сосуд после n качаний давление станет равным

При любом n р > р0, так как во время нагнетания воздуха при каждом качании насос захватывает воздух, имеющий атмосферное давление р0, а при откачке при каждом качании удаляется воздух при давлении, меньшем р0.
В запаянной с обоих концов цилиндрической трубке находится воздух при нормальных условиях. Трубка разделена подвижным поршнем на две части, объемы которых V1 и V2 относятся как 1 : 2. До какой температуры t1 следует нагреть воздух в меньшей части трубки и до какой t2 охладить в большей, чтобы поршень делил трубку на две равные части, если нагревание и охлаждение в обеих частях трубки производятся при условии 
Решение. Условие  означает, что процессы нагревания и охлаждения происходят изобарно. При отношении начальных объемов
означает, что процессы нагревания и охлаждения происходят изобарно. При отношении начальных объемов  эти объемы составляют
эти объемы составляют  и где V0 — объем всей трубки. Конечные объемы обеих частей одинаковы и равны
и где V0 — объем всей трубки. Конечные объемы обеих частей одинаковы и равны 
Согласно закону Гей-Люссака для воздуха в меньшей части трубки выполняется соотношение

где Т0 = 273 К — температура, соответствующая начальным условиям. Отсюда

В цилиндре под поршнем находится воздух при давлении p1 = 2 • 105 Па и температуре t1 = 27 °С. Определите массу т груза, который нужно положить на поршень после нагревания воздуха до температуры t2 = 50 °С, чтобы объем воздуха в цилиндре стал равен первоначальному. Площадь поршня S = 30 см 2 .
Решение. Так как в процессе нагревания объем воздуха в цилиндре не изменяется, то согласно закону Шарля имеем Решение. Так как в процессе нагревания объем воздуха в цилиндре не изменяется, то согласно закону Шарля имеем

Подставляя в (3.12.1) выражение для р 2 , получим

Найдите среднюю (эффективную) молярную массу сухого атмосферного воздуха, предполагая известный процентный состав воздуха по массе: азот — n1 = 75,52%, кислород — n2 = 23,15%, аргон — n3 = 1,28% и углекислый газ— n4 = 0,05%.
Решение. Для каждого газа можно записать уравнение состояния:

Здесь M1, M2, M3 и M4 — молярные массы соответственно азота, кислорода, аргона и углекислого газа.
Складывая правые и левые части этих уравнений, получим

Для смеси газов выполняется соотношение

где m = m1 + m2 + m3 + m4 — масса воздуха с объемом V, а М — искомая эффективная молярная масса.
Согласно закону Дальтона
Сравнивая уравнения состояния (3.12.2) и (3.12.3), получим

Разделив числитель и знаменатель на т и умножив на 100%, получим выражение для М через процентный состав воздуха по массе
Примеры решения задач по теме «Газовые законы»
«Физика — 10 класс»
Для этого нужно знать зависимость параметров друг от друга, которая в общем случае даётся уравнением состояния, а в частных — газовыми законами.
Баллон вместимостью V1 = 0,02 м3, содержащий воздух под давлением Pi — 4 • 10° Па, соединяют с баллоном вместимостью V2 = 0,06 м3, из которого воздух выкачан.
Определите давление р, которое установится в сосудах.
Температура постоянна.
Воздух из первого баллона займёт весь предоставленный ему объём V1 + V2.
По закону Бойля—Мариотта p1V1 = p(V2 + V1).
Отсюда искомое давление

В запаянной пробирке находится воздух при атмосферном давлении и температуре 300 К.
При нагревании пробирки на 100 °С она лопнула.
Определите, какое максимальное давление выдерживает пробирка.
Объём воздуха при нагревании остаётся постоянным.
Для определения давления в пробирке при нагревании до 100 °С применяем закон Шарля

По условию Т2 = 400 К.
Заметим, что изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия.

Однако разорваться пробирке мешает атмосферное давление.
Тогда окончательно давление, которое может выдержать пробирка, рmах = ратм + р2 ≈ 2,25 атм.
При нагревании газа при постоянном объёме на 1 К давление увеличилось на 0,2 %.
Чему равна начальная температура газа?
Газ нагревается при постоянном объёме — процесс изохорный.
По закону Шарля

где Т2 = Т1 + ΔТ.
Из условия задачи следует, что р2 = p1 • 1,002, т. е.

откуда Т1 = ΔТ/0,002 = 500 К.
Давление воздуха внутри бутылки, закрытой пробкой, равно 0,1 МПа при температуре t1 = 7 °С.
На сколько градусов нужно нагреть воздух в бутылке, чтобы пробка вылетела?
Без нагревания пробку можно вынуть, прикладывая к ней силу 30 Н.
Площадь поперечного сечения пробки 2 см 2 .
Чтобы пробка вылетела из бутылки, необходимо, чтобы давление воздуха в бутылке было равно

При нагревании объём не изменяется.
По закону Шарля



Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Устали? — Отдыхаем!



- Парадоксы

- Это интересно

- История техники

- Физика детям

- Библиотека

- Знаете ли вы

- История физики

- Любознательным

- Мысли вслух

- Выпускникам
Как сдавать экзамены?
Тактика тестирования
Знаешь ли ты себя?
На урок 

- Поделиться
- Сегодня на занятии мы должны научиться решать конкурсные задачи с использованием газовых законов. Для этого придется вспомнить курс физики.
- Задачи для самостоятельной работы типовые и нестандартные можно найти в приложении 1. Там же представлены решения пяти различных по сложности задач
§ 66. Примеры решения задач по теме «Газовые законы»
Если при переходе газа из начального состояния в конечное один из параметров не меняется, то разумно использовать один из газовых законов (10.6), (10.7) или (10.9).
Задача 1. Баллон вместимостью V1 = 0,02 м3, содержащий воздух под давлением Pi — 4 • 10° Па, соединяют с баллоном вместимостью V2 = 0,06 м3, из которого воздух выкачан. Определите давление р, которое установится в сосудах. Температура постоянна.
Р е ш е н и е. Воздух из первого баллона займёт весь предоставленный ему объём V1 + V2. По закону Бойля—Мариотта p1V1 = p(V2 + V1).
Отсюда искомое давление 
Задача 2. В запаянной пробирке находится воздух при атмосферном давлении и температуре 300 К. При нагревании пробирки на 100 °С она лопнула. Определите, какое максимальное давление выдерживает пробирка.
Р е ш е н и е. Объём воздуха при нагревании остаётся постоянным.
Для определения давления в пробирке при нагревании до 100 °С применяем закон Шарля 
По условию Т2 = 400 К. Заметим, что изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия.
Тогда давление 
Однако разорваться пробирке мешает атмосферное давление. Тогда окончательно давление, которое может выдержать пробирка, рmах = ратм + р2 ≈ 2,25 атм.
Задача 3. При нагревании газа при постоянном объёме на 1 К давление увеличилось на 0,2 %. Чему равна начальная температура газа?
Р е ш е н и е. Газ нагревается при постоянном объёме — процесс изохорный. По закону Шарля  где Т2 = Т1 + ΔТ. Из условия задачи следует, что р2 = p1 • 1,002, т. е.
где Т2 = Т1 + ΔТ. Из условия задачи следует, что р2 = p1 • 1,002, т. е.  откуда Т1 = ΔТ/0,002 = 500 К.
откуда Т1 = ΔТ/0,002 = 500 К.
Задача 4. Давление воздуха внутри бутылки, закрытой пробкой, равно 0,1 МПа при температуре t1 = 7 °С. На сколько градусов нужно нагреть воздух в бутылке, чтобы пробка вылетела? Без нагревания пробку можно вынуть, прикладывая к ней силу 30 Н. Площадь поперечного сечения пробки 2 см 2 .
Р е ш е н и е. Чтобы пробка вылетела из бутылки, необходимо, чтобы давление воздуха в бутылке было равно 
При нагревании объём не изменяется. По закону Шарля  откуда
откуда  Следовательно,
Следовательно,

Задачи для самостоятельного решения
1. Компрессор, обеспечивающий работу отбойных молотков, засасывает из атмосферы воздух объёмом V = 100 л в 1 с. Сколько отбойных молотков может работать от этого компрессора, если для каждого молотка необходимо обеспечить подачу воздуха объёмом V1 = 100 см 3 в 1 с при давлении р = 5 МПа? Атмосферное давление р0 = 100 кПа.
2. Определите температуру газа, находящегося в закрытом сосуде, если давление газа увеличивается на 0,4 % от первоначального давления при нагревании на 1 К.
3. Высота пика Ленина на Памире равна 7134 м. Атмосферное давление на этой высоте равно 3,8 • 10 4 Па. Определите плотность воздуха на вершине пика при температуре 0 °С, если плотность воздуха при нормальных условиях 1,29 кг/м 3 .
Образцы заданий ЕГЭ
С1. Идеальный газ изотермически сжали из состояния с объёмом 6 л так, что давление газа изменилось в 3 раза. На сколько уменьшился объём газа в этом процессе?
С2. Поршень площадью 10 см 2 и массой 5 кг может без трения перемещаться в вертикальном цилиндрическом сосуде, обеспечивая при этом его герметичность. Сосуд с поршнем, заполненный газом, покоится на полу неподвижного лифта при атмосферном давлении 100 кПа, при этом расстояние от нижнего края поршня до дна сосуда 20 см. Каким станет это расстояние, когда лифт поедет вверх с ускорением, равным 2 м/с 2 ? Изменение температуры газа не учитывайте.
С3. С идеальным газом происходит изобарный процесс, в котором для увеличения объёма газа на 150 дм 3 его температуру увеличивают в 2 раза. Масса газа постоянна. Каким был первоначальный объём газа?
С4. Идеальный одноатомный газ в количестве ν = 0,09 моль находится в равновесии в вертикальном цилиндре под поршнем массой 5 кг. Трение между поршнем и стенками цилиндра отсутствует. Внешнее атмосферное давление p0 = 100 кПа. В результате нагревания газа поршень поднялся на высоту Δh = 4 см, а температура газа повысилась на ΔТ = 16 К. Чему равна площадь поршня?
С5. Идеальный газ изохорно нагревают так, что его температура изменяется на ΔТ = 240 К, а давление — в 1,8 раза. Масса газа постоянна. Определите начальную температуру газа по шкале Кельвина.
Урок химии в 11-м классе: «Решение задач с использованием газовых законов»
Разделы: Химия
РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ГАЗОВЫХ ЗАКОНОВ
Урок химии в 11 классе
Цели урока: получить практические навыки применения газовых законов для решения химических задач,
установить межпредметные связи с физикой и экологией.
Тип урока: урок закрепления и обобщения изученного материала
Форма урока: практическое занятие
Основные методы: объяснительно-иллюстративный, метод проблемного изложения учебного материала, самостоятельная работа учащихся.
Средства обучения: справочный материал; тексты задач.
I. Блок мотивации и актуализации.
Постановка цели:
II. Блок изучения материала.
(весь изложенный ниже теоретический материал имеется у учащихся в виде карточек)
— Итак, какие газовые законы известны вам из курса физики?
(ученики называют законы, учитель записывает их на доске)
а) Закон Бойля-Мариотта 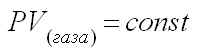
При постоянной температуре произведение давления газа на его объем есть величина постоянная, или объем газа обратно пропорционален давлению, при котором он находится.
б) Закон Гей-Люссака 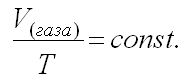
При постоянном давлении изменение объема газа прямо пропорционально температуре.
в) Закон Шарля 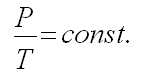
При постоянном объеме давление прямо пропорционально температуре.
г) Объединенный газовый закон 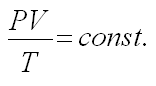
д) Уравнение Клапейрона – Менделеева 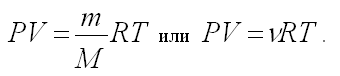
Давайте более подробно рассмотрим уравнение Клапейрона – Менделеева и вспомним, что означают входящие в него величины 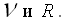
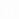
Вопрос учащимся: Что означает величина R?
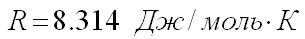 (универсальная газовая постоянная).
(универсальная газовая постоянная).
Вопрос учащимся: Что означает величина 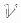 ?
?
— Это количество вещества.
Вопрос учащимся: В каких единицах измеряется количество вещества?
— Для измерения количества вещества используют особую величину “моль” . 1 моль содержит столько структурных частиц, сколько атомов углерода содержится в 12 г изотопа C12.
В 1 моль содержится примерно 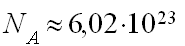 структурных частиц.
структурных частиц.
Вопрос учащимся: Как можно найти количество вещества?
— Для того, чтобы найти количество вещества, надо массу разделить на молярную массу:
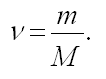
Часто используют понятие молярного объема V(m), который равен объему одного моль вещества. 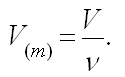
С использованием понятия молярного объема уравнение Клапейрона – Менделеева
может быть записано в виде: 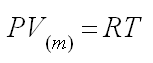
— Теперь вспомним один из важнейших законов химии — Закон Авогадро.
е) Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Для химических расчетов применяют следствия из Закона Авогадро:
Следствие 1 Моль любого газа при нормальных условиях занимает один и тот же объем, равный приблизительно 22,4 л.
Вопрос учащимся: Какие параметры характеризуют состояние газа при нормальных условиях? ( ученики перечисляют, учитель записывает).
Нормальными условиями считаются: давление 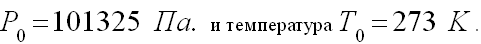
Таким образом, в соответствии с законом Авогадро: 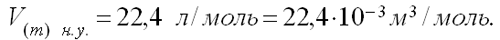
Вопрос учащимся: При решении задач часто приходится проводить расчеты для условий, отличающихся от нормальных. Как привести параметры газа к нормальным условиям?
Для приведения объема газа к нормальным условиям можно пользоваться объединенным газовым законом:
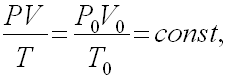 где V — объем газа при давлении P и температуре T
где V — объем газа при давлении P и температуре T
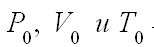 – параметры, характеризующие параметры газа при нормальных условиях.
– параметры, характеризующие параметры газа при нормальных условиях.
Масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в равных объемах газов при одинаковых условиях содержится одинаковое число молекул, то очевидно, что отношение масс равных объемов газов будет равно отношению их молекулярных масс или отношению численно равных им молярных масс, то есть m1/m2 = M1/M2, где
m1 — масса объема первого газа,
m2 — масса такого же объема второго газа,
M1 — молярная масса первого газа,
M2 — молярная масса второго газа.
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется относительной плотностью первого газа по второму (обозначается буквой — D).
Обычно плотность газов определяют по отношению к водороду M(H2) = 2 г/моль или к воздуху М(возд.) = 29 г/моль. В итоге получим: М = 2D (H2) и M = 29 D( возд.).
Таким образом, зная плотность газа по водороду или по воздуху, можно легко определить его молярную, а, следовательно, и относительную молекулярную массу и сформулировать II следствие из закона Авогадро.
Следствие 2 Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее (легче) другого, т.е. равна отношению плотностей газов или молярных масс.
Молярная масса вещества (M), а значит, и относительная молекулярная масса (Mr) вещества в газообразном состоянии, численно равна удвоенной плотности паров этого вещества по водороду.
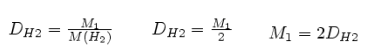
Измерения объемов газов обычно производят при условиях, отличных от нормальных.
Если мы рассматриваем смесь газов, необходимо использовать закон Дальтона
ж) Закон Дальтона (для газовой смеси)
Общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь: 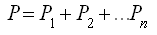
Пояснение. В некоторых текстах задач встречаются внесистемные единицы измерений различных величин; необходимо уметь их переводить в систему СИ.
Внесистемные единицы давления: 1 атм.=101325 Па; 1 мм рт. ст. = 133,3 Па.
Перевод температуры: 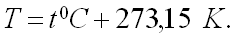
T — температура по шкале Кельвина, t 0 C — температура по шкале Цельсия.
— Итак, мы повторили основные теоретические положения и сейчас перейдем к практике и научимся решать задачи этого типа. У Вас на столах находятся тексты задач – разбираем 1-ю задачу.
I этап
(учитель сам решает с объяснением задачу у доски)
Задача 1.
Какой объем (н.у.) займут 0,4•10 -3 м 3 газа, находящегося при 50 о С и давлении 0,954•10 5 Па?
Учитель записывает на доске, ученики в тетради условие:
Отсюда 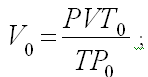
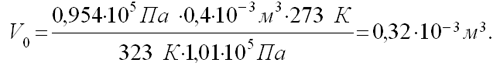
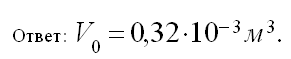
(текст задачи читают сами учащиеся, записывают условие задачи в тетрадь; учитель комментирует решение, записывая его на доске)
Масса 0,327•10 -3 м 3 газа, при 13 о С и давлении 1,04•10 5 Па равна 0,828•10 -3 кг. Вычислить молярную массу газа.
(Учитель предлагает составить план решения данной задачи; опрашивает 2-3 учеников, затем решает задачу на доске с их помощью).
t = 50 o C; T=323 К
Для решения задачи применим уравнение Клапейрона – Менделеева
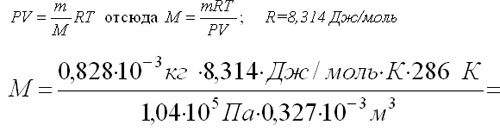
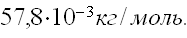
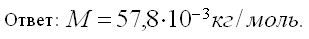
Задача 3, аналогичная предыдущей; дается время (3-5 минут), чтобы все решали на местах. Для выполнения задания учитель вызывает сильного ученика, чтобы он объяснил у доски решение данной задачи.
Задача 3.
Определить молярную массу ацетона, если он в парообразном состоянии при температуре 87 о С и давлении 720 мм рт. ст. занимает объем 0,5 л навеска взятого вещества 0,93 г.
Ответ: 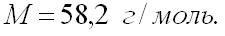
Решение этой задачи аналогично решению предыдущей. Особенностью является необходимость перевода давления из мм рт. ст. в Паскали.
Предлагаются тексты задач по мере их усложнения. Каждый решает индивидуально. Учитель наблюдает, как учащиеся справляются с заданиями. Первый решивший выписывает на доске свое решение и комментирует его.
225 г паров хлорбензола, находясь при температуре 25 о С в резервуаре на 10 л, создают давление в 0,51 МПа. Оцените отклонение состояния этих паров от идеального газа. Чем можно объяснить такое отклонение?
V = 10 л =10 -2 м 3 t = 25 o C; T=298 К М=142,5•10 -3 кг/моль
По данным задачи определяем, какое могло бы быть давление идеального газа при тех же условиях, и сравниваем с давлением реального газа
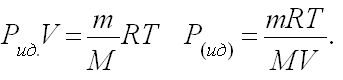
Подставляем значения величин данные в условии задачи.
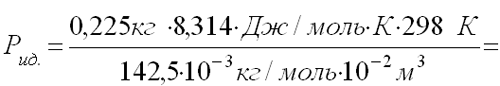
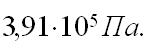
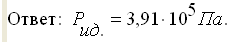 Изменение давления можно объяснить взаимодействием молекул.
Изменение давления можно объяснить взаимодействием молекул.
III. Блок подведения итогов и рефлексии
Сегодня на уроке мы вспомнили основные газовые законы, их математические выражения, единицы измерения, потренировались на конкретных примерах в решении задач на газовые законы, в основном на уравнение Клапейрона – Менделеева. На следующем занятии мы разберем задачи на смеси газов.
IV.Домашнее задание:
Повторить основные газовые законы, решить задачу однотипную с разобранной на уроке.
При подготовке к уроку была использована литература:
-
Архангельская О.В. Использование универсальной газовой постоянной при решении
задач //Химия в школе — 1994, №2, с. 51-53.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для
Газовые законы. Решение задач
Успейте воспользоваться скидками до 60% на курсы «Инфоурок»

Методическая разработка урока по физике в 10 классе по теме: «Газовые законы. Решение задач на изопроцессы»
Продолжительность урока – 90 минут(2- урока)
— уметь выводить газовые законы, понимать, читать и строить графики изопроцессов;
— способствовать выработке умений применять полученные знания при работе с графиками;
— формировать умение применять полученные знания на практике;
— развивать аналитические и практические умения учащихся;
— развивать навыки самостоятельной и исследовательской работы, анализа своей работы, взаимоконтроля, развивать устную речь, с целью развития познавательного интереса учащихся;
— воспитывать умение высказывать свою точку зрения, слушать других, принимать участие в диалоге;
— формировать способности к позитивному сотрудничеству;
— формирование мировоззренческих понятий о познаваемости мира, для воспитания чувства само- и взаимоуважения при работе в парах, группах.
Тип урока: урок изучения и первичного закрепления новых знаний.
Формы организации познавательной деятельности:
Техническое обеспечение урока : мультимедийный проектор, компьютер, интерактивная доска, презентация «Газовые законы», карточки-задания, листы самооценки.
2. Проверка домашнего задания (20 мин)
— Какова тема прошлого урока?
— Как выглядит уравнение Менделеева – Клапейрона?
— Для чего нужно это уравнение состояния для идеального газа?
Для проверки усвоения навыков решения задач на уравнение состояния идеального газа выполним самостоятельную работу. На столах лежат карточки – задания. Работаем с карточкой номер 1 по вариантам. Ваша задача – заполнить таблицу (приложение 1).
2 человека по вариантам выполняют тоже задание на полузакрытых досках. (слайд 1)
Учитель : Для проверки работы нам нужны критерии ее оценивания, давайте вместе сформулируем критерии – за что можно поставить оценку (учащиеся предлагают свои критерии).
На обратной стороне карточки записаны критерии оценивания работы. Посмотрите внимательно – совпадают ли наши критерии с теми, что предложены на листах? Обменяйтесь работами.
Проверяем задания, выполненные на доске, и сверяем их с ответами в ваших карточках. Ученики, работающие у доски, вносят свои ответы в таблицу на интерактивной доске.
Методом взаимоконтроля проверьте правильность выполнения задания и выставьте оценку. Передаем карточку с последних парт на первые.
Уравнение состояния идеального газа или связывает 3 макроскопических параметра, каких? (слайд 2)
Количественная зависимость между двумя параметрами газа при фиксированном значении третьего называют газовыми законами .
— Как вы считаете, сколько их и какие это могут быть уравнения – законы?
— Озвучьте тему нашего урока (слайд 3) и сформулируйте его цель ( спросить несколько человек и обобщить цель урока).
4. Изучение нового материала (15 мин.):
Учитель : Процессы, протекающие при неизменном значении одного из параметров называют изопроцессами (от греческого слова «изос» — равный). Изопроцесс – это идеализированная модель реального процесса, которая только приближенно отражает действительность.
— Сколько параметров связывает между собой уравнение состояния?
— Сколько изопроцессов мы должны изучить?
Для групповой работы класс делится на три группы (три ряда). Работая с учебником ( § 69 на стр. 186), каждая группа изучает изопроцесс по следующему плану исследования: (слайд 4)
1) определение изопроцесса;
2) формула закона, название закона;
3) историческая справка;
4) графическое изображение процесса;
5) название графика.
Итак, рассмотрим с вами три изопроцесса. Каких?
Каждая группа у доски представляет свой закон согласно плану. Одна группа выступает, другие две группы записывают в тетрадь.
Процесс изменения состояния системы макроскопических тел (термодинамической системы) при постоянной температуре называют изотермическим («изос» — равный; «термос» — теплый)
Историческая справка: этот закон экспериментально был открыт в 1662 г английским ученым Р.Бойлем и независимо от него несколько позже в 1676 г французским физиком Э.Мариоттом.
Поэтому оно носит название закона Бойля – Мариотта.
Зависимость давления газа от объема при постоянной температуре графически изображают кривой, которую называют изотермой .

Учитель: Этот изотермический процесс можно изобразить и в других координатных осях. Изобразим изотерму в координатах рТ и V Т.


Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (греч. сл. «барос» — тяжелый, вес)
Историческая справка: этот закон был установлен экспериментально в 1802 г. французским физиком Ж. Гей-Люссаком и носит название закона Гей-Люссака.
Графическая зависимость объема от температуры изображается прямой линией – изобарой . При очень низких температурах закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.

Учитель: Изобразим изобару в координатах рТ и рТ.


3 группа. III . Изохорный процесс (слайд 7)
Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным (греч. сл. «хорема» — вместимость).
Историческая справка: этот газовый закон был установлен в 1787 г французским физиком Ж. Шарлем и носит название закона Шарля .
Графическая зависимость давления от температуры изображается прямой линией – изохорой . 
Учитель: Изобразим изохору в координатах V Т и р V .


5. Закрепление пройденной темы ( 40 мин)
Учитель: Для проверки усвоения этого теоретического материала, я предлагаю провести небольшой проверочный тест. Можно воспользоваться своими конспектами. (тест выводится на экран, с последующей проверкой)
1. Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон …
2. Какой из приведенных ниже графиков соответствует изобарному расширению? ( А )

3. Какие три процесса представлены на диаграммах рисунка?

А. изохорный, изотермический, изобарный
В. изобарный, изохорный, изотермический
С. изохорный, изобарный, изотермический
Учитель : Итак, мы с вами изучили газовые законы. Какие это законы? А какова цель нашего урока? (спросить 2-3 чел.)
Наша задача – научиться представлять изопроцессы в различных координатах. Например, такой процесс:

Учитель: Рассмотрим способы решения задач на построение графиков изопроцессов в осях р V , р T , VT , если представлен один из графиков.
Важно запомнить , что для постоянной массы газа:
Температура выше на той изотерме, график которой лежит выше в координатах р V
Давление больше на той изобаре, график которой лежит ниже в координатах VT
Объем больше на той изохоре, график которой лежит ниже в координатах рТ
Вывод : для выяснения характера изменения параметра необходимо проводить соответствующие ему графики изопроцессов (изотермы, изобары, изохоры) 
Задание 1. Увеличивается или уменьшается давление газа в ходе процесса 1-2? ( слайд 10)
Проведем изобары через точки 1 и 2.
В ходе процесса осуществляется переход с изобары, лежащей выше, на изобару, лежащую ниже, следовательно, давление газа в ходе процесса 1 – 2 увеличивается. 
Задание 2 . Представьте процесс в координатах pT , VT . (слайд 11)
1) записываем уравнение состояния газа 
Начинаем построение точки таким образом, чтобы от нее можно было «идти» свободно в любом направлении. Смотрим подсказки ( в анализе ).

Учитель : На столах у вас лежит карточка номер 2 . Каждому варианту предлагается самостоятельно решить задачу на построение графиков изопроцессов. Можно воспользоваться вашими конспектами. (приложение 2)
Учитель : Время на выполнение работы закончено. Подпишите свои работы.
6. Подведение итогов. Рефлексия. (7 мин)
Учитель : Подведем итоги нашего урока (блиц-опрос).
— Какова тема сегодняшнего занятия?
— Вы все успешно справились с поставленной целью? Какой?
— Что вызвало у вас затруднение? Что не получилось?
А сейчас каждый из вас оценит свою деятельность на протяжении всего нашего занятия. На обратной стороне вашей карты № 2 изображена карта самооценки, на которой вы должны сделать пометки напротив каждого этапа, затем по ним вычертить график.
Ваши карты-задания сдайте на проверку, каждому будут выставлены оценки и озвучены на следующем уроке.
Наше занятие закончилось. Ваше домашнее задание будет следующим:
§ 69, сборник задач Рымкевича № 544. Для желающих: с помощью диаграмм изобразить какую-нибудь фигуру. (слайд 12)
Спасибо за работу и всех благодарю за сотрудничество. До свидания.
Список использованной литературы:
Физика. 10 класс: учеб.для общеобразват. учреждений: базовый и профил. уровни / Г.Я. мякишев, Б.Б. Буховцев, Н.Н. Сотский; под ред. В.И. Николаева, Н.А. Парфентьевой. – 20-е изд. – М.: Просвещение, 2011.
Физика. 10 класс. Тесты: в 2 ч. / Ю.Н. Сычев. Саратов: Лицей, 2012.
Физика. 10 класс. Поурочные планы. / сост. Г.В. Маркина. – издательство «Учитель», Волгоград, 2000 (стр. 21)
Универсальные поурочные разработки по физике: 10 класс. / В.А. Волков. – М.: ВАКО, 2007 (стр. 217)
Задачи по физике для профильной школы с примерами решений. 10-11 классы. / Л.А. Кирик, Л.Э. Генденштейн, И.М. Гельфгат; под ред. В.А. Орлова. – М.: ИЛЕКСА, 2008 (задача № 17.39 стр. 130, 134)
1. Запишите формулу Менделеева – Клапейрона
2. Запишите формулу для вычисления массы газа m :…………..…….
3. Запишите формулу для вычисления объема газа V :……………….