Правило траубе-дюкло
Оглавление:
Правило траубе-дюкло
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
4.1 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
4.1.2 Адсорбция на границе раствор – пар
В жидких растворах поверхностное натяжение σ является функцией от концентрации растворенного вещества. На рис. 4.1 представлены три возможных зависимости поверхностного натяжения от концентрации раствора (т.н. изотермы поверхностного натяжения). Вещества, добавление которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ), вещества, добавление которых увеличивает или не изменяет поверхностное натяжение – поверхностно-инактивными (ПИАВ).

Рис. 4.1 Изотермы поверхностного Рис. 4.2 Изотерма адсорбции
натяжения растворов ПИАВ (1, 2) и ПАВ на границе раствор – пар
ПАВ (3)
Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость – пар, т.е. того, что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.
Количественной мерой адсорбции на границе раствор-пар является поверхностный избыток Г (гамма), равный числу молей растворенного вещества в поверхностном слое. Количественное соотношение между адсорбцией (поверхностным избытком) растворенного вещества и изменением поверхностного натяжения раствора с ростом концентрации раствора определяет изотерма адсорбции Гиббса :
 (IV.5)
(IV.5)
График изотермы адсорбции ПАВ представлен на рис. 4.2. Из уравнения (IV.5) следует, что направление процесса – концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы – определяется знаком производной d σ /dС. Отрицательная величина данной производной соответствует накоплению вещества в поверхностном слое ( Г > 0), положительная – меньшей концентрации вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора.
Величину g = –d σ /dС называют также поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации С1 определяют графически, проводя касательную к изотерме поверхностного натяжения в точке С = С1; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
 (IV.6)
(IV.6)
Нетрудно заметить, что с ростом концентрации поверхностная активность ПАВ уменьшается. Поэтому поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае её величина, обозначаемая gо, зависит только от природы ПАВ и растворителя. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило:
В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу СН2 увеличивает поверхностную активность в 3 – 3.5 раза.
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации описывается эмпирическим уравнением Шишковского :
 (IV.6a)
(IV.6a)
Здесь b и K – эмпирические постоянные, причём значение b одинаково для всего гомологического ряда, а величина К увеличивается для каждого последующего члена ряда в 3 – 3,5 раза.

Рис. 4.3 Предельная ориентация молекул ПАВ в поверхностном слое
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу, так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии ориентации молекул полярной группой к полярной фазе (полярной жидкости), а неполярной – к неполярной фазе (газу или неполярной жидкости). При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ; при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности раздела фаз образуется слой «вертикально» ориентированных молекул ПАВ (рис. 4.3). Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г (рис. 4.1-4.2); при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются.
Copyright © С. И. Левченков, 1996 — 2005.
Справочник химика 21
Химия и химическая технология
Дюкло Траубе, правило
Сформулируйте правило Дюкло — Траубе и поясните его физический смысл. При каком строении поверхностных пленок соблюдается это правило В чем заключается обратимость этого правила [c.64]
Физический смысл правила Дюкло — Траубе [c.20]
Коллоидные ПАВ проявляют высо.чую поверхностную активность, которая зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу. —СН2— приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюкло — Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ. Так как иоверхностную активность определяют нри бесконечном разбавлении системы, то легко объяснить ее зависимость от длины углеводородного радикала. Чем длиннее радикал, тем сильнее выталкивается молекула ПАВ из водного раствора (уменьшается раство- [c.290]
Полученное выражение для соотношения г (п-Ы)/ Г (и) отражает правило Дюкло —Траубе. [c.44]
Определив AW, можно рассчитать величину коэффициента правила Дюкло — Траубе по формуле [c.133]
Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло — Траубе). [c.44]
Все многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трех типов (рис. 43). Для поверхностноактивных веществ (ПАВ) характерны кривые типа 1. ПАВ менее полярны по сравнению с растворителем, обладают меньшим, чем растворитель, поверхностным натяжением. Интенсивность взаимодействия молекул растворителя с молекулами ПАВ меньше, чем молекул растворителя между собой. По отношению к воде, полярному растворителю, поверхностно-активными веществами являются органические соединения, состоящие из углеводородного радикала (гидрофобная или олеофильная часть) и полярной группы (гидрофильная часть) карбоновые кислоты, их соли, спирты, амины. Такое дифильное строение молекулы является характерным признаком ПАВ. Углеводородные цепи, не имеющие постоянного дипольного момента, гидрофобны, взаимодействуют с молекулами воды слабее, чем между собой, и выталкиваются на поверхность. Поэтому органические вещества, не обладающие полярной группой (например, парафины, нафтены), в воде практически нерастворимы. Полярные группы типа —ОН, —СООН, —NH и др. обладают высоким сродством к воде, хорошо гидратируются, и наличие такой группы в молекуле обусловливает растворимость ПАВ. Таким образом, растворимость ПАВ в воде зависит от длины углеводородного радикала (растворимость уменьшается с увеличением длины в гомологическом ряду). Например, карбоновые кислоты i — С4 неограниченно растворяются в воде растворимость кислот С5 — С12 заметно падает с ростом числа С-атомов, а при длине углеводородной цепи более i2 они практически нерастворимы. Увеличение длины углеводородного радикала молекулы ПАВ на одну СНа-группу приводит к увеличению поверхностной активности в 3,2—3,5 раза (это правило называется правилом Дюкло — Траубе). [c.205]
Ленгмюровские представления об адсорбции позволяют объяснить и известное правило Дюкло—Траубе (1878 г.), которое, так же как и уравнение Шишковского, было установлено экспериментально для растворов низших жирных кислот. Согласно этому правилу, отношение концентраций двух соседних гомологов, которым соответствуют одинаковые А, постоянно и приблизительно равно 3,2. К такому же выводу можно прийти, исходя из уравнения Шишковского. Для п-го и (п + 1)-го гомологов из (4.42) имеем [c.111]
Уравнение (39) устанавливает зависимость поверхност-Бой активности от длины прямого насыщенного углеводородного радикала и, по существу, заключает в себе закономерность, известную как правило Дюкло — Траубе. Действительно, для (п+1)-го члена ряда можно записать [c.22]
В соответствии с уравнением (42) значение коэффициента правила Дюкло — Траубе р зависит от величины инкремента ЛШ. Уменьшение этой величины приводит к снижению различия в поверхностной активности гомологов и наоборот. [c.23]
Согласно Ленгмюру, правило Дюкло — Траубе можно обосновать следующим образом. Примем, что толщина поверхностного слоя равна O. Тогда средняя концентрация в этом слое будет Г/0. Из термодинамики известно, что максимальная работа А, требующаяся для сжатия газа от объема Fi до объема Vit может быть представлена как [c.126]
Отношение (VI. 37) отражает правило Дюкло — Траубе. Оно является постоянной величиной и для водных растворов при 20°С составляет 3,2. При температурах, отличных от 20 °С, постоянная имеет другие значения. Поверхностная активность пропорциональна также константе, входящей в уравнение Ленгмюра (или уравнение Шишковского), так как Кг = КАоо (III. 17) и Лоо— емкость монослоя — постоянна для данного гомологического ряда. Для органических сред правило Дюкло — Траубе обращается поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ. [c.291]
Легко видеть, что уравнения (76) и (77) аналогичны уравнению (39), выражающему правило Дюкло — Траубе. Это указывает на связь объемных и поверхностных свойств растворов ПАВ и подчеркивает общность явлений адсорбции и мицеллообразования. Действительно, в гомологических рядах ПАВ величина ККМ изменяется примерно обратно пропорционально поверхностной активности, так что отношение ККМ соседних гомологов соответствует коэффициенту правила Дюкло — Траубе [c.59]
Из этого уравнения видно, что работа адсорбции должна увеличиваться на постоянную величину при удлинении углеводородной цепи на группу СН2. Это значит, что при небольших концентрациях, при которых только и соблюдается правило Дюкло — Траубе, все группы СНа в цепи занимают одинаковое положение по отношению к поверхности, что возможно лишь, когда цепи расположены параллельно поверхности, т. е. лежат на ней. К вопросу об ориентации молекул поверхностно-активного вещества в поверхностном слое мы возвратимся ниже в этом разделе. [c.127]
Т. е. G обратно пропорциональна Теперь правило Дюкло—Траубе запишется так [c.132]
Правило Дюкло — Траубе так, как оно сформулировано выше, выполняется при температурах, близких к комнатной. При более высоких температурах отношение 3,2 уменьшается, стремясь к единице, так как с повышением температуры поверхностная активность снижается в результате десорбции молекул и различие между поверхностной активностью гомологов сглаживается. [c.127]
Однако это объяснение противоречит тому факту, что измеренные на тех же самых объектах величины Гоо соответствуют стоячему , а не лежачему положению молекул, благодаря чему они почти не зависят от п. Чтобы устранить это противоречие, делается предположение, что при малом заполнении слоя, когда правило Дюкло—Траубе выполняется, адсорбированные молекулы лежат на поверхности, а при увеличении их плотности они постепенно поднимаются . Но очевидно, что такая трактовка несовместима со строгим применением ленгмюровской изотермы, в которой Гоо считается постоянной величиной, не зависящей от степени заполнения адсорбционного слоя. [c.112]
Насколько соблюдается правило Дюкло — Траубе для гомологического ряда жирных кислот, можно видеть из данных табл. V, 4. Правило Дюкло — Траубе соблюдается не только для жирных кислот, но и для других гомологических рядов — спиртов, аминов и т. д. [c.127]
Другая формулировка правила Дюкло — Траубе сводится к тому, что когда длина цепи жирной кислоты возрастает в арифметической прогрессии, поверхностная активность увеличивается в геометрической прогрессии. Подобное же отношение, должно соблюдаться при удлинении молекулы и для величины jA, поскольку поверхностная активность веществ при достаточно малых концентрациях пропорциональна удельной капиллярной постоянной. [c.126]
Следует заметить также, что правило Дюкло — Траубе соблюдается лишь для водных растворов поверхностно-активных веществ. Для растворов этих же веществ в неполярных растворителях правило Дюкло — Траубе обращается, так как с увеличением [c.127]
В первом приближении можно также принять, что чем лучше среда растворяет адсорбтив, тем хуже идет в этой среде адсорбция. Это положение является одной из причин обращения правила Дюкло — Траубе. Так, когда адсорбция жирной кислоты происходит на гидрофильном адсорбенте (например, силикагеле) из углеводородной среды (например, из бензола), адсорбция с увеличением молекулярного веса кислоты не возрастает, как это следовало бы из правила Дюкло — Траубе, а уменьшается, так как высшие жирные кислоты лучше растворимы в неполярной среде. [c.139]
Понятно, что на непористых, с гладкими поверхностями адсорбентах такого обращения правила Дюкло — Траубе наблюдаться не может. [c.140]
Правило Дюкло — Траубе [c.320]
Правило Дюкло — Траубе для растворимых ПАВ выполняется в широком диапазоне концентраций, начиная от разбавленных растворов и кончая предельным насыщением поверхностных слоев. При этом коэффициент Траубе может быть выражен отношением концентраций, соответствующих насыщению поверхностного слоя [c.321]
Правило Дюкло — Траубе имеет важное теоретическое и практическое значение. Оно указывает верное направление при синтезе высокоактивных ПАВ с длинными цепями. [c.321]
Как формулируют правило Дюкло — Траубе Как его можно записать Как выглядят изотермы поверхностного натяжения двух соседних гомологов с числом атомов углерода п и п- — [c.346]
Связь между константами, входящими в уравнение Шишковского, и строением молекул поверхностно-активных веществ можно установить, если обратиться к закономерности, установленной Дюкло и Траубе. Дюкло обнаружил, что способность поверхностно-активных веществ снижать поверхностное натяжение воды в гомологическом ряду усиливается с ростом числа углеродных атомов. Траубе дополнил наблюдения Дюкло. Найденная этими исследователями зависимость между поверхностной активностью и числом углеродных атомов получила название правила Дюкло — Траубе при увеличении числа углеродных атомов в гомологическом ряду в арифметической прогрессии поверхностная активность возрастает в геометрической прогрессии, причем увеличению углеводородной части молекулы на одну группу СНз соответствует возрастание поверхностной активности примерно в 3—3,5 раза (в среднем в 3,2 раза). [c.59]
Правило Дюкло — Траубе наиболее точно выполняется при низких концентрациях растворенных веществ. Поэтому [c.59]
Из правила Дюкло — Траубе следует важный вывод площадь, приходящаяся на одну молекулу при максимальном насыщении адсорбционного слоя, остается постоянной в пределах одного гомологического ряда. [c.59]
Алифатические обратимые конкурентные ингибиторы. Как видно из рис. 37, сррбционный участок активного центра малоспецифичен по отношению к структуре алифатической цепи в молекуле ингибитора (алканолы). Независимо от того, является ли алифатическая цепь нормальной или разветвленной, эффективность обратимого связывания алканола КОН на активном центре определяется валовой гидрофобностью группы К. А именно, величина lg i, характеризующая прочность комплекса, возрастает линейно (с наклоном, близким к единице) со степенью распределения 1 Р этих соединений между водой и стандартной органической фазой (н-октанол). Наблюдаемая при этом величина инкремента свободной энергии переноса СНа-группы из воды в среду активного центра равна приблизительно —700 кал/моль (2,9 кДж/моль) (для низших членов гомологического ряда). Эта величина близка к значению инкремента свободной энергии, которое следует из известного в коллоидной химии правила Дюкло—Траубе [90—92] и характерна для свободной энергии перехода жидкой СНа-группы из воды в неводную (гидрофобную) среду [85]. Все это позволяет рассматривать гидрофобную область активного центра химотрипсина как каплю органического растворителя, расположенную в поверхностном слое белковой глобулы. Эта капля либо адсорбирует гидрофобный ингибитор из воды на поверхность раздела фаз, либо, будучи расположенной несколько углубленно, полностью экстрагирует его. С точки зрения микроскопической структуры гидрофобной области правильнее было бы рассматривать ее как фрагмент мицеллы, однако такая детализация представляется излишней, поскольку известно, что свободная энергия перехода н-алканов из воды в микроскопическую среду мицеллы додецилсульфата слабо отличается от свободной энергии выхода тех же соединений из воды в макроскопическую жидкую неполярную фазу [93].. [c.142]
Адсорбция из органической фазы. В этом случае в соседнюю (водную) фазу переходит лишь полярная группа. Следовательно, работа адсорбции определяется только разностью энергии межмолекулярного взаимодействия полярных групп в органической фазе и воде, т. е. изменением их энергетического состояния при переходе из органической жидкости в воду. Поскольку углеводородные радикалы остаются в органической фазе, то пААУдаО и работа адсорбции из органической фазы равна Уо. В таком случае работа адсорбции не должна зависеть от длины углеводородного радикала и правило Дюкло — Траубе не должно соблюдаться. Действительно, как показывают экспериментальные данные, все нормальные спирты и кислоты примерно одинаково адсорбируются из парафиновых углеводородов на границе с водой. Это хорошо иллюстрирует рис. 4 [2, с. 94]. Величи- [c.29]
Следовательно, поверхностная активность соединения тем больше, чем сильнее выражена полярная асимметрия молекулы. Влияние неполярной части молеку.1ы ПАВ на поверхностную активность проявляется наиболее чакономерно в гомологических рядах (рис. 20.1). Г. Дюкло обнаружил эту закономерность, которую затем П. Траубе более точно сформулировал в виде правила, получившего название правила Дюкло — Траубе [c.320]
Величину р называют коэффициентом Траубе. Теоретическое объяснение правила Дюкло — Траубе было дано позже И. Ленгмю-ром. Он вычислил выигрыш энергии для двух соседних гомологов при переходе их углеводородных цепей из воды в воздух и нашел, что разность, соответствуюшая энергии перехода одной СНз-группы, постоянна в гомологических рядах и близка к, 3 кДж/моль. Выигрыш энергии обус ювлен тем, что при вытеснении неполярной цепи из водной среды в воздух диполи воды соединяются и энергия Гиббса системы уменьшается. Вместе с тем уменьшается энергия Гиббса и цепи ПАВ, перешедшей в среду, к которой имеет большое сродство по полярности. [c.321]
Влияние длины цепи ПАВ. В гомологических рядах с увеличением молекулярной массы ПАВ величина ККМ уменьшается примерно обратно пропорционально поверхностной активности (ККМл 1/0м). Для соседних гомологов отношение ККМ имеет значение коэффициента правила Дюкло—Траубе (ККМ) /(ККМ) +1 Р = 3,2. [c.444]
Ленгмюр показал, что правило Дюкло — Траубе мохкет быть использовано для расчета энергии переноса группы — Hj— из объема раствора в газовую фазу. Действительно, рассматривая Ь как константу адсорбционного равновесия [на с. 61 локазано, что для эквивалентной величины К справедливо K=kJ в соответствии с уравнением стандартной изотермы реакций имеем [c.63]
Смотреть страницы где упоминается термин Дюкло Траубе, правило: [c.604] [c.7] [c.22] [c.140] [c.89] Коллоидная химия 1982 (1982) — [ c.54 ]
Поверхностная активность. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе.
Поверхностная активность, способность вещества при адсорбции на границе раздела фаз понижать поверхностное натяжение (межфазное натяжение). Адсорбция Г в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с в-ва в фазе, из которой вещество адсорбируется на межфазную поверхность, уравнением Гиббса (1876):  где R-газовая постоянная, Т-абс. температура (см. Адсорбция). Производная
где R-газовая постоянная, Т-абс. температура (см. Адсорбция). Производная 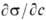 служит мерой способности вещества понижать поверхностное натяжение на данной межфазной границе и также наз. поверхностной активностью. Обозначается G (в честь Дж. Гиббса), измеряется в Дж•м/моль (гиббсах).
служит мерой способности вещества понижать поверхностное натяжение на данной межфазной границе и также наз. поверхностной активностью. Обозначается G (в честь Дж. Гиббса), измеряется в Дж•м/моль (гиббсах).
Поверхностно-активные вещества (ПАВ), вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой (жидкой, твердой или газообразной) приводит к значит. понижению поверхностного натяжения (см. Поверхностная активность). В наиболее общем и важном с практической точки зрения случае адсорбирующиесямолекулы (ионы) ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводороднаяжидкость, неполярная поверхность твердого тела) обладает углеводородный радикал, который выталкивается из полярной среды. В водном растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно поверхности (нормальная ориентация).
Концентрация ПАВ в адсорбционном слое на несколько порядков выше, чем в объеме жидкости, поэтому даже при ничтожно малом содержании в воде (0,01-0,1% по массе) ПАВ могут снижать поверхностное натяжение воды на границе с воздухом с 72,8•10 -3 до 25•10 -3 Дж/м 2 , т.е. практически до поверхностного натяжения углеводородныхжидкостей. Аналогичное явление имеет место на границе водный раствор ПАВ — углеводородная жидкость, что создает предпосылки для образования эмульсий.
В зависимости от состояния ПАВ в растворе условно различают истинно растворимые (молекулярно-диспергированные) и коллоидные ПАВ. Условность такого разделения состоит в том, что одно и то же ПАВ может относиться к обеим группам в зависимости от условий и хим. природы (полярности) растворителя. Обе группы ПАВ адсорбируются на фазовых границах, т. е. проявляют в растворах поверхностную активность, в то время как объемные свойства, связанные с возникновением коллоидной (мицеллярной) фазы, проявляют лишь коллоидные ПАВ. Указанные группы ПАВ отличаются значением безразмерной величины, которая наз. гидрофильно-липофильным балансом (ГЛБ) и определяется отношением:
Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического веществас длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза [1] .Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границахгомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу.
Правило было сформулировано И. Траубе (нем.)русск. в 1891 году [2] в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде. Предшествующие исследования Э. Дюкло [3] хотя и были близки по духу к работам Траубе, но не предлагали никакой ясной зависимости концентрации, поэтому в зарубежной литературе правило носит лишь имя Траубе. [4] . Термодинамическую интерпретацию правила Траубе дал в 1917 году И. Ленгмюр. [5]
Дата добавления: 2016-01-16 ; просмотров: 1995 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
правило Дюкло-Траубе
Большой англо-русский и русско-английский словарь . 2001 .
правило Дюкло-Траубе — Правило Дюкло Траубе: с ростом длины углеродной цепи веществ одного гомологичного ряда адсорбция на неполярном адсорбенте из полярного растворителя возрастает примерно в 3 раза при увеличении углеводородной цепи на одну метиленовую группу CH2… … Химические термины
Правило Дюкло — Траубе зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу… … Википедия
Общая химия : учебник . А. В. Жолнин ; под ред. В. А. Попкова, А. В. Жолнина. . 2012 .
Смотреть что такое «правило Дюкло-Траубе» в других словарях:
ПОВЕРХНОСТНОЕ ДАВЛЕНИЕ — (плоское давление, двумерное давление), сила, действующая на единицу длины границы раздела (барьера) чистой поверхности жидкости и поверхности той же жидкости, покрытой адсорбц. слоем поверхностно активного вещества. П. д. направлено в сторону… … Физическая энциклопедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
ИММУНИТЕТ — ИММУНИТЕТ. Содержание: История и современ. состояние учения об И. . 267 И. как явление приспособления. 283 И. местный. 285 И. к животным ядам. 289 И. при протозойн. и спирохета, инфекциях . 291 И. к… … Большая медицинская энциклопедия
Правило Траубе-Дюкло;
Как уже отмечалось, поверхностно-активные молекулы, способные адсорбироваться на поверхности раздела раствор–газ, должны быть дифильными, т.е. иметь полярную и неполярную части.
Дюкло, а затем Траубе, изучая поверхностное натяжение водных растворов гомологического ряда предельных жирных кислот, установили, что поверхностная активность (−  ) этих веществ на границе раствор–воздух тем больше, чем больше длина углеводородного радикала, причем в среднем она увеличивается в 3–3,5 раза на каждую группу –СН2– . Эта важная закономерность получила название правила Траубе-Дюкло.
) этих веществ на границе раствор–воздух тем больше, чем больше длина углеводородного радикала, причем в среднем она увеличивается в 3–3,5 раза на каждую группу –СН2– . Эта важная закономерность получила название правила Траубе-Дюкло.
Правило Траубе—Дюклогласит:
в гомологическом ряду нормальных жирных одноосновных кислот поверхностная активность их (−  ) по отношению к воде резко возрастает в 3–3,5 раза на каждую группу –СН2– при равной молярной концентрации.
) по отношению к воде резко возрастает в 3–3,5 раза на каждую группу –СН2– при равной молярной концентрации.
Другая формулировка правила Траубе—Дюкло: “Когда длина цепи жирной кислоты возрастает в арифметической прогрессии, поверхностная активность увеличивается в геометрической прогрессии”. Правило Траубе—Дюкло хорошо иллюстрируется рисунком 18.1.
Как видно из рисунка, чем выше стоит вещество в гомологическом ряду, тем сильнее оно понижает поверхностное натяжение воды при данной концентрации.
Причина зависимости, установленной правилом Траубе—Дюкло, заключается в том, что с увеличением длины радикала уменьшается растворимость жирной кислоты и увеличивается стремление ее молекул перейти из объема в поверхностный слой. Установлено, что правило Траубе—Дюкло соблюдается не только для жирных кислот, но и для других гомологических рядов – спиртов, аминов и т.д.

Рис. 18.1 Правило Траубе—Дюкло:
1− уксусная кислота,2− пропионовая кислота,3− масляная кислота,4−валериановая кислота.
1) только при малых концентрациях, когда значение −  – максимально;
– максимально;
2) для температур, близких к комнатной. При более высоких температурах множитель 3–3,5 уменьшается и стремится к единице. Увеличение температуры способствует десорбции молекул и поэтому поверхностная активность их уменьшается (различие между поверхностной активностью гомологов сглаживается);
3) только для водных растворов. ПАВ.
Американский физико-химик Ленгмюр установил, что правило Траубе справедливо лишь для малых концентраций ПАВ в растворе при свободном расположении адсорбированных молекул на поверхности (рис.18.6).
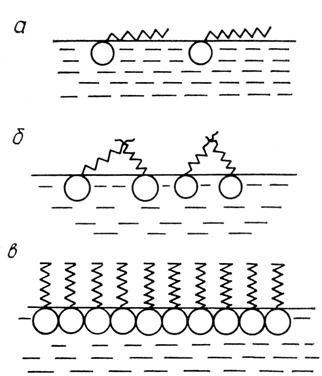
Рис. 18.6 Расположение адсорбированных молекул на границе раздела фаз:
а – при малых концентрациях; б – при средних концентрациях;
в – в насыщенном слое при максимально возможной адсорбции
ПРАВИЛО ДЮКЛО-ТРАУБЕ
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной  , однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при с
, однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при с  0). Эту величину П. А. Ребиндер (1924) назвал поверхностной активностью g:
0). Эту величину П. А. Ребиндер (1924) назвал поверхностной активностью g:
 (3.4)
(3.4)
[g] = Дж–м 3 /м 2 -моль = Дж–м/моль или Н-м 2 /моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой 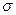 =f(c) в точке ее пересечения с осью ординат.
=f(c) в точке ее пересечения с осью ординат.
Таким образом, для ПАВ: g > 0;  0. Для ПИВ: g 0, Гi
0. Для ПИВ: g 0, Гi

Этим же объясняется инактивность сахарозы, молекула которой наряду с неполярным углеводородным каркасом имеет много полярных групп, поэтому в молекуле имеется баланс полярной и неполярной части.
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило:
Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3–3,5 раза при удлинении углеводородной цепи на одно звено (группу –CH2).
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот.

Рис.3.4. Изотерма поверхностного натяжения некоторых кислот
1 – СН3СООН – уксусная кислота (nс=1); 2 – СН3СН2СООН – пропионовая кислота (nс =2); 3 – СН3(СН2)2СООН – масляная кислота (nс =3); 4 – СН3(СН2)3СООН – изовалериановая кислота (nс = 4); 5 – СН3(СН2)4СООН – капроновая кислота (nс =5); nс – число атомтов С в углеводородном радикале.